Definition af Pauli-eksklusionsprincippet
Kemi Definition af Paulis udelukkelsesprincip
Pauli-eksklusionsprincippet siger, at enhver elektron skal være i sin egen unikke tilstand. Med andre ord må ingen elektroner i et atom have et identisk sæt kvantetal.

Pauli-ekskluderingsprincippet er kernen i kemien og hjælper med at forklare elektronarrangementerne i atomer og molekyler og hjælper med at rationalisere mønstre i det periodiske system.
I kemi anvendes Pauli-eksklusionsprincippet udelukkende på elektroner, som vi er ved at diskutere.
Wolfgang Pauli modtog 1945 Nobelprisen i fysik for sin opdagelse, da den gjaldt elektroner.
Senere blev det fundet, at Pauli-udelukkelsesprincippet havde en brederebetydning, som vi vil nævne i slutningen af denne side.
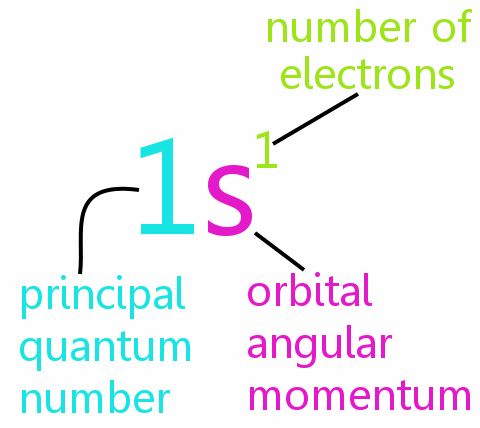
Fire kvantetal
Hver elektron i et atom kan defineres fuldstændigt med fire kvantetal:
• n: det primære kvantetal
• l: det orbitale vinkelmomentkvantumnummer
• ml: det magnetiske kvantetal
• ms: spin-kvantetallet
Eksempel på Pauli-eksklusion Princip
Overvej argonets elektronkonfiguration:
Princippet om udelukkelse hævder, at enhver elektron i et argonatom er i en unik tilstand.
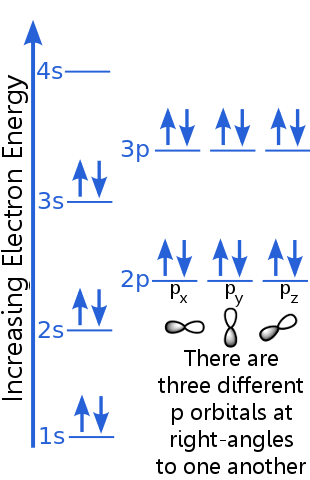
1s-niveauet kan rumme to elektroner med identiske n, l og ml kvantetal. Argon “s par elektroner i 1s orbital tilfredsstiller udelukkelsesprincippet, fordi de har modsatte spins, hvilket betyder at de har forskellige spin-kvantetal, ms. Det ene spin er + ½, det andet er -½. (I stedet for at sige + ½ eller -½ siges elektronerne at være spin-up ![]() eller spin-down
eller spin-down ![]() .)
.)
Elektronerne på 2-niveauet har et andet hovedkvantetal end dem i 1-orbitalen. Paret med 2-elektroner adskiller sig fra hinanden, fordi de har modsatte spins.
Elektronerne på 2p-niveau har et andet antal orbitalvinkelmomentum end dem, der er i s-orbitalerne, deraf bogstavet p snarere end s. Der er tre p-orbitaler med samme energi, px, py og pz. Disse orbitaler er forskellige fra hinanden, fordi de har forskellige retninger i rummet. Hver af px-, py- og pz-orbitalerne kan rumme et par elektroner med modsatte spins. ; dette orbital rummer et elektronpar med modsatte spins.
3p-niveauets beskrivelse svarer til beskrivelsen for 2p, men det primære kvantetal er højere: 3p ligger ved en højere energi end 2p.
Generel definition af Pauli-eksklusionsprincippet
Elektroner tilhører en bred klasse af subatomære partikler kaldet fermioner. Fermioner har spin-kvante tal med halvtalsværdier.
Kvarker (op og ned) og leptoner (elektroner, elektronneutrinoer, muoner, muonneutrinoer, taus og tau neutrinoer) er alle fermioner.
Alle fermioner og partikler afledt af fermioner, såsom protoner og neutroner, adlyder Fermi-Dirac-statistikker; dette inkluderer adlydelse af Pauli-udelukkelsesprincippet.
Pauli-udelukkelsesprincippet siger, at ingen to identiske fermioner samtidigt kan indtage det samme kvantetilstand.
Pauli-udelukkelsesprincippet gælder ikke for bosoner: disse er partikler, der adlyder Bose-Einstein-statistikker; de alle har heltalsværdier af spin. Fotoner, gluoner, gravitoner og W-, Z- og Higgs-bosoner er alle bosoner.
