Definicja zasady wykluczania Pauliego
Definicja chemiczna zasady wykluczania Pauliego
Zasada wykluczenia Pauliego mówi, że każdy elektron musi być Innymi słowy, żadne elektrony w atomie nie mogą mieć identycznego zestawu liczb kwantowych.

Zasada wykluczenia Pauliego leży u podstaw chemii, pomagając wyjaśnić układy elektronów w atomach i cząsteczkach oraz pomagając zracjonalizować wzory w układzie okresowym.
W chemii zasada wykluczenia Pauliego jest stosowana wyłącznie do elektronów, które mamy zamiar omówić.
Wolfgang Pauli otrzymał w 1945 roku Nagrodę Nobla w dziedzinie fizyki za swoje odkrycie w odniesieniu do elektronów.
Później stwierdzono, że zasada wykluczenia Pauliego ma szerszy zakresznaczenie, o którym wspomnimy na końcu tej strony.
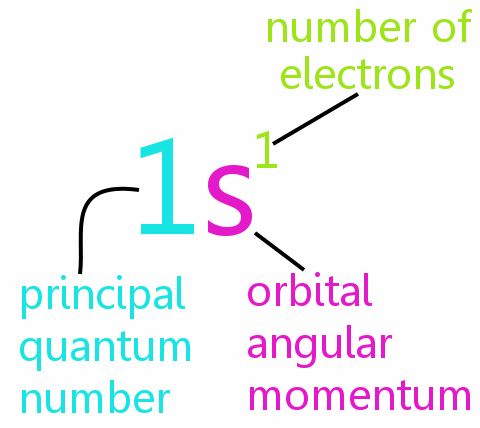
Cztery liczby kwantowe
Każdy elektron w atomie można w całości zdefiniować za pomocą czterech liczb kwantowych:
• n: główna liczba kwantowa
• l: liczba kwantowa pędu orbitalnego
• ml: magnetyczna liczba kwantowa
• ms: spinowa liczba kwantowa
Przykład wykluczenia Pauliego Zasada
Rozważmy konfigurację elektronów argonu:
Zasada wykluczenia zakłada, że każdy elektron w atomie argonu jest w unikalnym stanie.
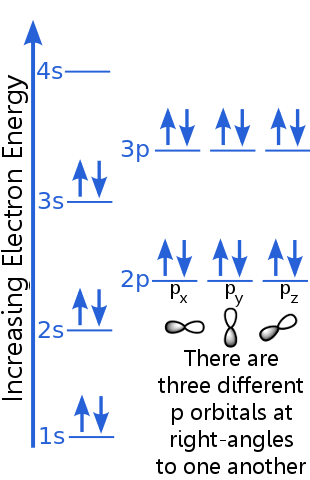
Poziom 1s może pomieścić dwa elektrony o identycznych liczbach kwantowych n, l i ml. Argon „s para elektronów na orbicie 1s spełnia zasadę wykluczenia, ponieważ mają przeciwne spiny, co oznacza, że mają różne spinowe liczby kwantowe, ms. Jeden spin to + ½, a drugi to -½. (Zamiast mówić + ½ lub -½, często mówi się, że elektrony są spin-up ![]() lub spin-down
lub spin-down ![]() .)
.)
Elektrony na poziomie 2s mają inną główną liczbę kwantową niż elektrony na orbicie 1s. Para elektronów 2s różni się od siebie, ponieważ mają przeciwne spiny.
Elektrony poziomu 2p mają inną liczbę orbitali pędu kątowego niż te na orbitali s, stąd litera p zamiast s. Istnieją trzy orbitale p o równej energii, px, py i pz. Orbitale różnią się od siebie, ponieważ mają różne orientacje w przestrzeni. Każdy z orbitali px, py i pz może pomieścić parę elektronów o przeciwnych spinach.
Poziom 3s wznosi się do wyższej głównej liczby kwantowej ; ten orbital mieści parę elektronów o przeciwnych spinach.
Opis poziomu 3p jest podobny do opisu dla 2p, ale główna liczba kwantowa jest wyższa: 3p leży przy energii wyższej niż 2p.
Ogólna definicja zasady wykluczania Pauliego
Elektrony należą do szerokiej klasy cząstek subatomowych zwanych fermionami. Fermiony mają kwant spinowy liczby z wartościami połówkowymi.
Kwarki (góra i dół) i lepton (elektrony, neutrina elektronowe, miony, neutrina mionowe, taus i neutrina tau) są fermionami.
Wszystkie fermiony i cząstki pochodzące z fermionów, takie jak protony i neutrony, są zgodne ze statystykami Fermi-Diraca; obejmuje to również przestrzeganie zasady wykluczenia Pauliego.
Zasada wykluczenia Pauliego mówi, że żadne dwa identyczne fermiony nie mogą jednocześnie zajmować tego samego stan kwantowy.
Zasada wykluczenia Pauliego nie ma zastosowania do bozonów: są to cząstki zgodne ze statystyką Bosego-Einsteina; wszystkie mają wartości całkowite spin.Photony, gluony, grawitony, a bozony W, Z i Higgsa są bozonami.
