Définition du principe dexclusion de Pauli
Définition de la chimie du principe dexclusion de Pauli
Le principe dexclusion de Pauli dit que chaque électron doit être dans son propre état unique.En dautres termes, aucun électrons dans un atome ne peut avoir un ensemble identique de nombres quantiques.

Le Le principe dexclusion de Pauli est au cœur de la chimie, aidant à expliquer les arrangements électroniques dans les atomes et les molécules, et aidant à rationaliser les modèles dans le tableau périodique.
En chimie, le principe dexclusion de Pauli est appliqué uniquement aux électrons, dont nous sommes sur le point de discuter.
Wolfgang Pauli a reçu le prix Nobel de physique en 1945 pour sa découverte appliquée aux électrons.
Plus tard, le principe dexclusion de Pauli sest avéré avoir une portée plus largesens, que nous mentionnerons à la fin de cette page.
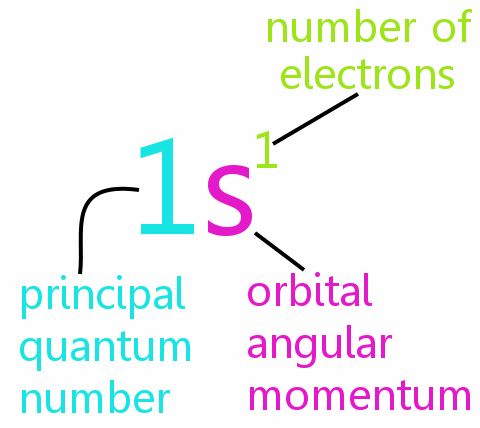
Quatre nombres quantiques
Chaque électron dun atome peut être défini complètement par quatre nombres quantiques:
• n: le nombre quantique principal
• l: le nombre quantique de moment angulaire orbital
• ml: le nombre quantique magnétique
• ms: le nombre quantique de spin
Exemple dexclusion de Pauli Principe
Considérons la configuration électronique de largon:
Le principe dexclusion affirme que chaque électron dans un atome dargon est dans un état unique.
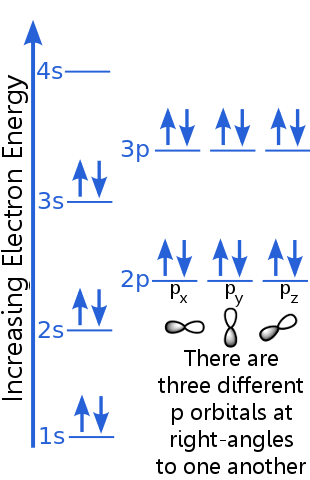
Le niveau 1 peut accueillir deux électrons avec des nombres quantiques identiques n, l et ml.Argon « s paire délectrons dans lorbitale 1s satisfont au principe dexclusion car ils ont des spins opposés, ce qui signifie quils ont des nombres quantiques de spin différents, ms. Un spin vaut + ½, lautre vaut -½. (Au lieu de dire + ½ ou -½, on dit souvent que les électrons sont spin-up ![]() ou spin-down
ou spin-down ![]() .)
.)
Les électrons de niveau 2 ont un nombre quantique principal différent de ceux de lorbitale 1. La paire délectrons 2 diffère les uns des autres car ils ont des spins opposés.
Les électrons de niveau 2p ont un nombre de moment angulaire orbital différent de ceux des orbitales s, doù la lettre p plutôt que s.Il y a trois orbitales p dénergie égale, les px, py et pz. Les orbitales sont différentes les unes des autres parce quelles ont des orientations différentes dans lespace. Chacune des orbitales px, py et pz peut accueillir une paire délectrons avec des spins opposés.
Le niveau 3s sélève à un nombre quantique principal plus élevé ; cette orbitale accueille une paire délectrons avec des spins opposés.
La description du niveau 3p est similaire à celle de 2p, mais le nombre quantique principal est plus élevé: 3p se situe à une énergie supérieure à 2p.
Définition générale du principe dexclusion de Pauli
Les électrons appartiennent à une large classe de particules subatomiques appelées fermions. Les fermions ont un quantum de spin nombres avec des valeurs demi-entières.
Les quarks (haut et bas) et leptons (électrons, neutrinos électroniques, muons, neutrinos muoniques, neutrinos taus et tau) sont tous des fermions.
Tous les fermions et particules dérivés de fermions, tels que les protons et les neutrons, obéissent aux statistiques de Fermi-Dirac; cela inclut le respect du principe dexclusion de Pauli.
Le principe dexclusion de Pauli dit quaucun fermion identique ne peut occuper simultanément le même état quantique.
Le principe dexclusion de Pauli ne sapplique pas aux bosons: ce sont des particules qui obéissent aux statistiques de Bose-Einstein; elles ont des valeurs entières de spin.Photons, gluons, gravitons et les bosons W, Z et Higgs sont tous des bosons.
