Definice Pauliho vylučovacího principu
Chemie Definice Pauliho vylučovacího principu
Pauliho vylučovací princip říká, že každý elektron musí být jinými slovy, v žádném elektronu v atomu není povoleno mít identickou množinu kvantových čísel.

Princip vyloučení Pauliho leží v srdci chemie, pomáhá vysvětlit elektronové uspořádání v atomech a molekulách a pomáhá racionalizovat vzorce v periodické tabulce.
V chemii se princip vyloučení Pauliho používá pouze na elektrony, o kterém se chystáme diskutovat.
Wolfgang Pauli obdržel v roce 1945 Nobelovu cenu za fyziku za svůj objev, protože se vztahoval na elektrony.
Později bylo zjištěno, že Pauliho princip vylučovánívýznam, který zmíníme na konci této stránky.
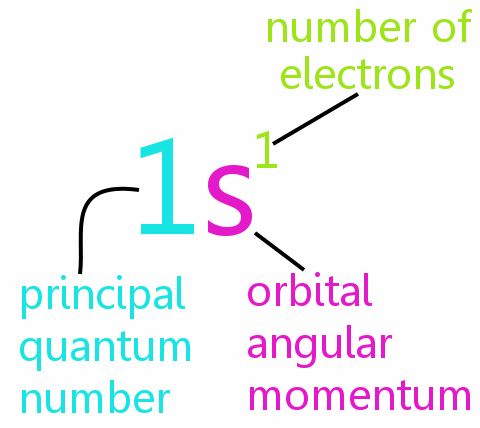
Čtyři kvantová čísla
Každý elektron v atomu lze definovat úplně čtyřmi kvantovými čísly:
• n: hlavní kvantové číslo
• l: kvantové číslo orbitální momentu hybnosti
• ml: magnetické kvantové číslo
• ms: kvantové číslo rotace
Příklad vyloučení Pauli Princip
Zvažte konfiguraci elektronů argonu:
Princip vyloučení tvrdí, že každý elektron v atomu argonu je v jedinečném stavu.
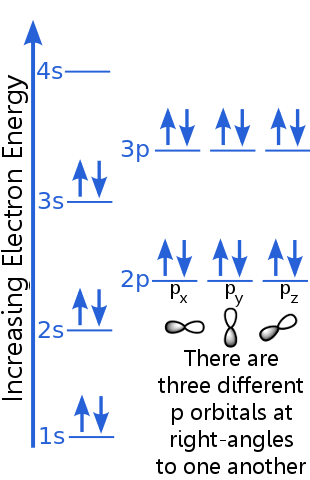
Úroveň 1s může pojmout dva elektrony se stejnými kvantovými čísly n, 1 a ml. Argon pár elektronů na orbitálu 1 s splňuje zásadu vyloučení, protože mají opačné otáčky, což znamená, že mají různá kvantová čísla spinů, ms. Jedna rotace je + ½, druhá je -½. (Místo toho, aby se říkalo + ½ nebo -½, často se říká, že elektrony jsou spin-up ![]() nebo spin-down
nebo spin-down ![]() .)
.)
Elektrony na úrovni 2 s mají jiné hlavní kvantové číslo než ty na orbitě 1 s. Dvojice 2s elektronů se od sebe liší, protože mají protilehlá otočení.
Elektrony na úrovni 2p mají jiné orbitální číslo momentu hybnosti než na orbitálech s, proto písmeno p spíše než s. Existují tři p orbitaly stejné energie, px, py a pz. orbitaly se navzájem liší, protože mají různou orientaci v prostoru. Každý z orbitalů px, py a pz může pojmout pár elektronů s opačnými rotacemi.
Úroveň 3 s stoupá na vyšší hlavní kvantové číslo ; tento orbitál pojme elektronový pár s protilehlými rotacemi.
Popis úrovně 3p je podobný popisu pro 2p, ale hlavní kvantové číslo je vyšší: 3p leží na vyšší energii než 2p.
Obecná definice Pauliho vylučovacího principu
Elektrony patří do široké třídy subatomárních částic zvaných fermiony. Fermiony mají spinové kvantum čísla s polovičními celočíselnými hodnotami.
Kvarky (nahoru a dolů) a leptony (elektrony, elektronová neutrina, miony, mionová neutrina, tausová a tau neutrina) jsou fermiony.
Všechny fermiony a částice odvozené od fermionů, jako jsou protony a neutrony, se řídí statistikou Fermi-Dirac; to zahrnuje dodržování Pauliho vylučovacího principu.
Pauliho vylučovací princip říká, že žádné dva identické fermiony nemohou současně obsadit stejné kvantový stav.
Pauliho princip vyloučení se nevztahuje na bosony: jedná se o částice, které se řídí Bose-Einsteinovými statistikami; všechny mají celočíselné hodnoty rotace. Fotony, gluony, gravitony a bosony W, Z a Higgs jsou všechny bosony.
