Definisjon av Pauli Exclusion Principle
Chemistry Definisjon av Paulis utelukkelsesprinsipp
Pauli-eksklusjonsprinsippet sier at hvert elektron må være i sin egen unike tilstand. Med andre ord har ingen elektroner i et atom tillatelse til å ha et identisk sett med kvantetall.

The Pauli-eksklusjonsprinsippet er kjernen i kjemien, og hjelper til med å forklare elektronarrangementene i atomer og molekyler, og hjelper til med å rasjonalisere mønstre i det periodiske systemet.
I kjemi brukes Pauli-eksklusjonsprinsippet utelukkende på elektroner, som vi er i ferd med å diskutere.
Wolfgang Pauli mottok 1945 Nobelprisen i fysikk for sin oppdagelse da den gjaldt elektroner.
Senere ble det funnet at Pauli-utelukkelsesprinsippet hadde en brederebetydning, som vi vil nevne på slutten av denne siden.
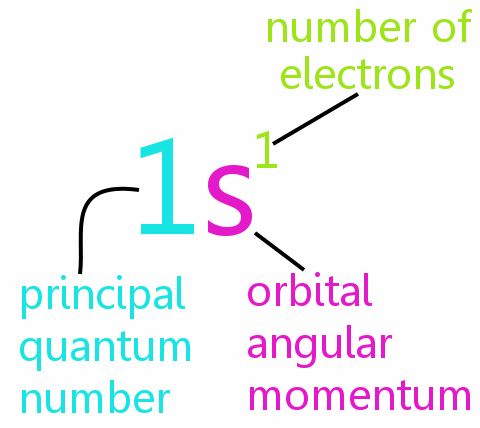
Fire kvantetall
Hvert elektron i et atom kan defineres fullstendig av fire kvantetall:
• n: det viktigste kvantetallet
• l: det orbitale vinkelmomentkvantantallet
• ml: det magnetiske kvantetallet
• ms: spinnkvantantallet
Eksempel på Pauli-ekskludering Prinsipp
Vurder argons elektronkonfigurasjon:
Ekskluderingsprinsippet hevder at hvert elektron i et argonatom er i en unik tilstand.
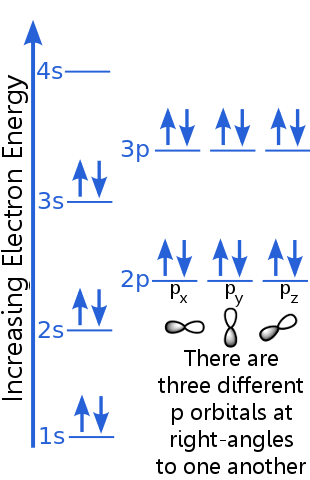
1s-nivået har plass til to elektroner med identiske n, l og ml kvantetall. Argon «s elektronpar i 1s orbital tilfredsstiller utelukkelsesprinsippet fordi de har motsatte spinn, noe som betyr at de har forskjellige spinnkvantantall, ms. Det ene spinnet er + ½, det andre er -½. (I stedet for å si + ½ eller -½ sies det ofte at elektronene er spin-up ![]() eller spin-down
eller spin-down ![]() .)
.)
Elektronene på 2-nivået har et annet hovedkvantetall enn de i 1-orbitalen. Paret med 2-elektroner skiller seg fra hverandre fordi de har motsatte spinn.
Elektronene på 2p-nivå har et annet vinkelmomenttall fra de i s orbitaler, derav bokstaven p i stedet for s. Det er tre p-orbitaler med lik energi, px, py og pz. Disse orbitaler er forskjellige fra hverandre fordi de har forskjellige retninger i rommet. Hver av px-, py- og pz-orbitalene har plass til et par elektroner med motsatte spinn.
3s-nivået stiger til et høyere hovedkvantetall ; denne orbitalen har plass til et elektronpar med motsatte spinn.
3p-nivåets beskrivelse er lik den for 2p, men hovedkvantetallet er høyere: 3p ligger ved en høyere energi enn 2p.
Generell definisjon av Pauli-ekskluderingsprinsippet
Elektroner tilhører en bred klasse av subatomære partikler kalt fermioner. Fermioner har spinnkvantum tall med halvtallverdier.
Kvarker (opp og ned) og leptoner (elektroner, elektronnøytrinoer, muoner, muonneutrinoer, taus og tau nøytrinoer) er alle fermioner.
Alle fermioner og partikler avledet fra fermioner, slik som protoner og nøytroner, adlyder Fermi-Dirac-statistikk; dette inkluderer å adlyde Pauli-utelukkelsesprinsippet.
Pauli-utelukkelsesprinsippet sier at ingen to identiske fermioner samtidig kan okkupere det samme kvantetilstand.
Prinsippet om utelukkelse av Pauli gjelder ikke bosoner: dette er partikler som adlyder Bose-Einstein-statistikken; de alle har heltallverdier av spinn. Fotoner, gluoner, gravitoner og W-, Z- og Higgs-bosonene er alle bosoner.
