Paulin poissulkemisperiaatteen määritelmä
Paulin poissulkemisperiaatteen kemian määrittely
Paulin poissulkemisperiaatteen mukaan jokaisen elektronin on oltava omassa ainutlaatuisessa tilassaan. Toisin sanoen millään atomin elektronilla ei saa olla identtisiä kvanttilukuja.

Paulin poissulkemisperiaate on kemian ytimessä, mikä auttaa selittämään atomien ja molekyylien elektronijärjestelyjä ja auttaa järkeistämään jaksollisen järjestelmän malleja.
Kemiaa koskevaa Paulin poissulkemisperiaatetta sovelletaan yksinomaan elektroneihin, josta olemme aikeissa keskustella.
Wolfgang Pauli sai 1945: n fysiikan Nobel-palkinnon löytöstään, kun se koski elektroneja.
Myöhemmin Paulin poissulkemisperiaatteella todettiin olevan laajempimerkitys, jonka mainitsemme tämän sivun lopussa.
Neljä kvanttilukua
Jokainen atomin elektroni voidaan määrittää kokonaan neljällä kvanttiluvulla:
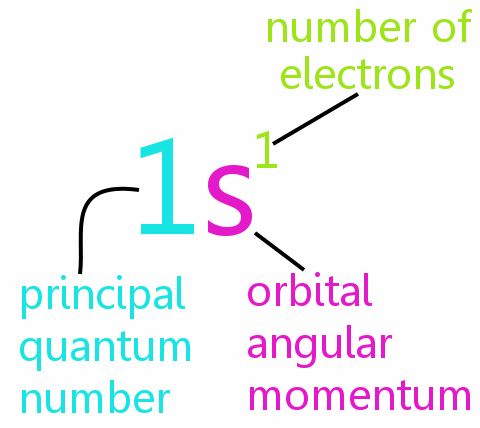
• n: pääkvanttiluku
• l: kiertoradan kulmamomenttikvanttinumero
• ml: magneettinen kvanttiluku
• ms: spin-kvanttiluku
Esimerkki Paulin poissulkemisesta Periaate
Harkitse argonin elektronikonfiguraatiota:
Poissulkemisperiaate väittää, että jokainen elektroni argonatomissa on ainutlaatuisessa tilassa.
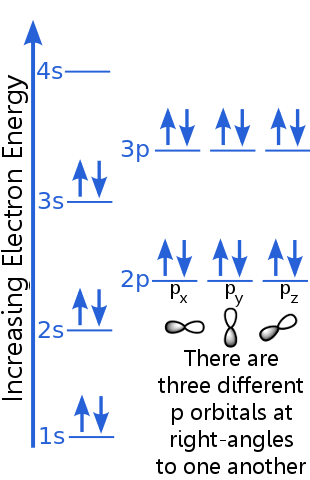
1s-tasoon mahtuu kaksi elektronia, joilla on identtiset n-, l- ja ml-kvanttiluvut.Argon ”s elektronipari 1s-kiertoradalla täyttää poissulkemisperiaatteen, koska niillä on vastakkaiset pyöräytykset, mikä tarkoittaa, että niillä on erilaiset spin-kvanttiluvut, ms. Yksi spin on + ½, toinen on -½. (Sen sijaan, että sanottaisiin + ½ tai -½, elektronien sanotaan olevan spin-up ![]() tai spin-down
tai spin-down ![]() .)
.)
2s-tason elektronilla on erilainen pääkvanttiluku kuin 1s-kiertoradalla. 2s-elektroniparilla on eroja, koska niillä on vastakkaiset pyöräytykset.
2p-tason elektronilla on erilainen orbitaalinen kulmamomentin numero kuin s-orbitaaleissa, joten kirjain p on pikemminkin kuin s. On olemassa kolme p-orbitaalia, joilla on sama energia, px, py ja pz. orbitaalit eroavat toisistaan, koska niillä on erilainen orientaatio avaruudessa. Jokaiseen px-, py- ja pz-orbitaaliin mahtuu pari elektroneja, joilla on vastakkaiset pyöräytykset.
3s-taso nousee korkeammaksi pääkvanttiluvuksi ; tämä kiertorata sisältää elektroniparin, jolla on vastakkaiset pyöräytykset.
3p-tason kuvaus on samanlainen kuin 2p: n, mutta pääkvanttiluku on suurempi: 3p on korkeammalla energialla kuin 2p.
Paulin poissulkemisperiaatteen yleinen määritelmä
Elektronit kuuluvat laajaan subatomisten hiukkasten ryhmään, jota kutsutaan fermioneiksi. Fermioneilla on spin-kvantti numerot, joissa on puoli kokonaislukuarvo.
Kvarkit (ylös ja alas) ja leptonit (elektronit, elektronineutriinot, müonit, müonneutriinot, taus ja tau-neutriinot) ovat kaikki fermioneja.
Kaikki fermionit ja fermionista peräisin olevat hiukkaset, kuten protonit ja neutronit, noudattavat Fermi-Dirac-tilastoja; tämä sisältää Paulin poissulkemisperiaatteen noudattamisen.
Paulin poissulkemisperiaatteen mukaan kaksi identtistä fermionia ei voi samanaikaisesti käyttää samaa kvanttitila.
Paulin poissulkemisperiaate ei koske bosoneja: nämä ovat hiukkasia, jotka noudattavat Bose-Einsteinin tilastoja; ne kaikki on spinin kokonaislukuarvot. Fotonit, gluonit, gravitonit ja W-, Z- ja Higgs-bosonit ovat kaikki bosoneja.
