Definiția principiului de excludere Pauli
Chimie Definiția principiului de excludere a lui Pauli
Principiul de excludere Pauli spune că fiecare electron trebuie să fie în propria sa stare unică. Cu alte cuvinte, nici un electron din atom nu are voie să aibă un set identic de numere cuantice.

The Principiul excluderii Pauli se află în centrul chimiei, ajutând la explicarea aranjamentelor electronice din atomi și molecule și contribuind la raționalizarea modelelor din tabelul periodic.
În chimie, principiul excluderii Pauli se aplică exclusiv electronilor, despre care urmează să discutăm.
Wolfgang Pauli a primit Premiul Nobel pentru fizică din 1945 pentru descoperirea sa, care s-a aplicat electronilor.
Mai târziu, s-a constatat că principiul de excludere Pauli are unsens, pe care îl vom menționa la sfârșitul acestei pagini.
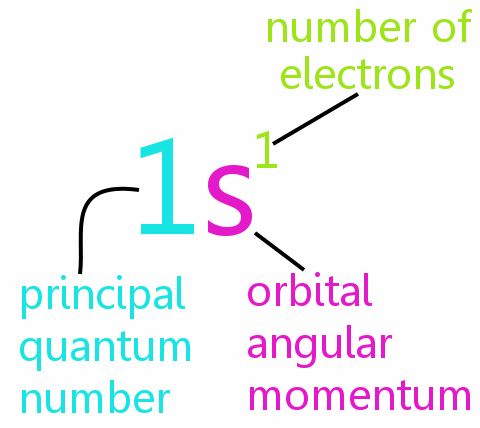
Patru numere cuantice
Fiecare electron dintr-un atom poate fi definit complet prin patru numere cuantice:
• n: numărul cuantic principal
• l: numărul cuantic al momentului unghiular orbital
• ml: numărul cuantic magnetic
• ms: numărul cuantic spin
Exemplu de excludere Pauli Principiu
Luați în considerare configurația electronică a argonului:
Principiul excluderii afirmă că fiecare electron într-un atom de argon este într-o stare unică.
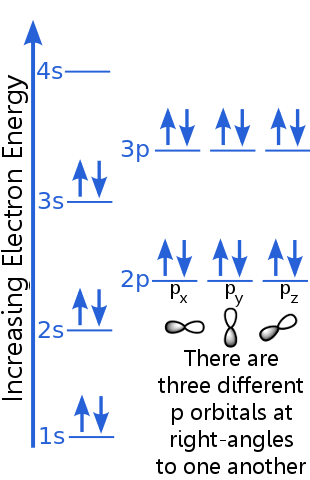
Nivelul 1s poate găzdui doi electroni cu numere cuantice identice n, l și ml. Argon „s perechea de electroni din orbitalul 1s îndeplinește principiul excluderii deoarece au rotiri opuse, ceea ce înseamnă că au numere cuantice diferite de rotire, ms. O rotire este + ½, cealaltă este -½. (În loc să spună + ½ sau -½ deseori se spune că electronii sunt spin-up ![]() sau spin-down
sau spin-down ![]() .)
.)
Electronii de nivel 2s au un număr cuantic principal diferit de cei din orbitalul 1s. Perechea de electroni 2s diferă între ei deoarece au rotiri opuse.
Electronii de nivel 2p au un număr de moment unghiular orbital diferit de cei din orbitalele s, de unde litera p mai degrabă decât s. Există trei orbitali p de energie egală, px, py și pz. orbitalii sunt diferiți unul de celălalt, deoarece au orientări diferite în spațiu. Fiecare dintre orbitalele px, py și pz pot găzdui o pereche de electroni cu rotiri opuse.
Nivelul 3s crește la un număr cuantic principal mai mare ; acest orbital găzduiește o pereche de electroni cu rotiri opuse.
Descrierea nivelului 3p este similară cu cea pentru 2p, dar numărul cuantic principal este mai mare: 3p se află la o energie mai mare decât 2p.
Definiția generală a principiului de excludere Pauli
Electronii aparțin unei clase largi de particule subatomice numite fermioni. Fermiunile au cuantum de spin numere cu valori pe jumătate de număr întreg.
Quarcurile (sus și jos) și leptonii (electroni, neutrini electronici, muoni, neutrini muoni, taus și tau neutrini) sunt fermioni.
Toți fermionii și particulele derivate din fermioni, cum ar fi protonii și neutronii, respectă statisticile Fermi-Dirac; aceasta include respectarea principiului excluderii Pauli.
Principiul excluderii Pauli spune că nu există doi fermioni identici care pot ocupa simultan același lucru. starea cuantică.
Principiul excluderii Pauli nu se aplică bosonilor: acestea sunt particule care respectă statisticile lui Bose-Einstein; toate acestea au valori întregi de spin. Fotografiile, gluonii, gravitonii și bosonii W, Z și Higgs sunt toți bosoni.
