Pauli 배제 원칙의 정의
Pauli의 배제 원칙의 화학 정의
Pauli 배제 원칙은 모든 전자가 즉, 원자의 전자는 동일한 양자 번호 집합을 가질 수 없습니다.

Pauli 배제 원리는 화학의 핵심으로 원자와 분자의 전자 배열을 설명하고 주기율표의 패턴을 합리화하는 데 도움이됩니다.
화학에서 Pauli 배제 원리는 전자에만 적용됩니다. 우리가 논의하려고합니다.
Wolfgang Pauli는 1945 년 노벨 물리학상을 전자에 적용한 발견으로 수상했습니다.
나중에 Pauli 배제 원리는 더 넓은 범위를 갖는 것으로 밝혀졌습니다.의미는이 페이지의 끝에서 언급 할 것입니다.
4 개의 양자 수
원자의 모든 전자는 4 개의 양자 수로 완전히 정의 될 수 있습니다.
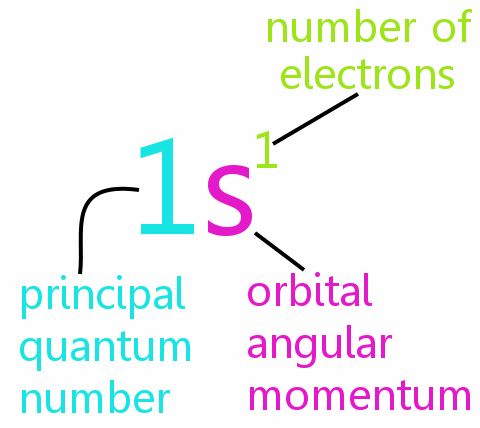
• n : 주 양자 수
• l : 궤도 각운동량 양자 수
• ml : 자기 양자 수
• ms : 스핀 양자 수
Pauli 제외의 예 원리
아르곤의 전자 구성 고려 :
배타 원칙은 모든 전자가 아르곤 원자는 고유 한 상태입니다.
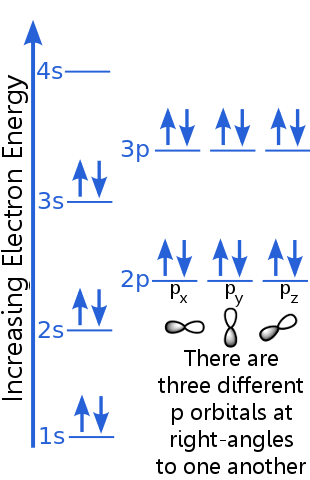
1s 수준은 동일한 n, l 및 ml 양자 번호를 가진 두 개의 전자를 수용 할 수 있습니다. 아르곤 “s 1s 궤도의 전자 쌍은 반대 스핀을 가지므로 배제 원리를 충족합니다. 즉, 스핀 양자 수 (ms)가 다릅니다. 하나의 스핀은 + ½이고 다른 하나는 -½입니다 (+ ½ 또는 -½을 말하는 대신 종종 전자가 스핀 업 ![]() 또는 스핀 다운
또는 스핀 다운 ![]() .)
.)
2s 레벨 전자는 1s 궤도에있는 것과 다른 주 양자 수를 갖습니다. 2s 전자 쌍은 반대 스핀을 가지고 있기 때문에 서로 다릅니다.
2p 레벨 전자는 s 궤도에있는 것과 다른 궤도 각운동량 수를 가지므로 문자 p는 s가 아닙니다. 동일한 에너지의 3 개의 p 궤도, 즉 px, py 및 pz가 있습니다. 궤도는 공간에서 방향이 다르기 때문에 서로 다릅니다. px, py 및 pz 궤도는 각각 반대 스핀을 가진 전자 쌍을 수용 할 수 있습니다.
3s 수준은 더 높은 주 양자 수로 상승합니다. ; 이 궤도는 반대 스핀을 가진 전자 쌍을 수용합니다.
3p 수준의 설명은 2p의 경우와 유사하지만 주 양자 수는 더 높습니다. 3p는 2p보다 높은 에너지에 있습니다.
Pauli 배제 원리의 일반 정의
전자는 페르미온이라고하는 광범위한 아 원자 입자에 속합니다. 페르미온은 스핀 양자를가집니다. 반정 수 값을 가진 숫자입니다.
쿼크 (위 및 아래) 및 렙톤 (전자, 전자 중성미자, 뮤온, 뮤온 중성미자, 타 우스 및 타우 중성미자)은 모두 페르미온입니다.
양성자와 중성자와 같은 페르미온에서 파생 된 모든 페르미온과 입자는 페르 미디 락 통계를 따릅니다. 여기에는 파울리 배제 원리도 포함됩니다.
파울리 배제 원칙은 두 개의 동일한 페르미온이 동시에 같은 것을 차지할 수 없다고 말합니다. 양자 상태.
파울리 제외 원리는 보손에 적용되지 않습니다. 이들은 보스-아인슈타인 통계를 따르는 입자입니다. spin의 정수 값을 갖습니다. 광자, 글루온, 중력자, W, Z 및 Higgs boson은 모두 boson입니다.
