Definizione del principio di esclusione di Pauli
Definizione chimica del principio di esclusione di Pauli
Il principio di esclusione di Pauli dice che ogni elettrone deve essere nel suo stato unico. In altre parole, a nessun elettrone in un atomo è consentito avere un insieme identico di numeri quantici.

Il Il principio di esclusione di Pauli è al centro della chimica, aiuta a spiegare la disposizione degli elettroni negli atomi e nelle molecole e aiuta a razionalizzare i modelli nella tavola periodica.
In chimica il principio di esclusione di Pauli è applicato esclusivamente agli elettroni, di cui stiamo per discutere.
Wolfgang Pauli ricevette nel 1945 il Premio Nobel per la fisica per la sua scoperta applicata agli elettroni.
In seguito si scoprì che il principio di esclusione di Pauli aveva una più ampiasignificato, che menzioneremo alla fine di questa pagina.
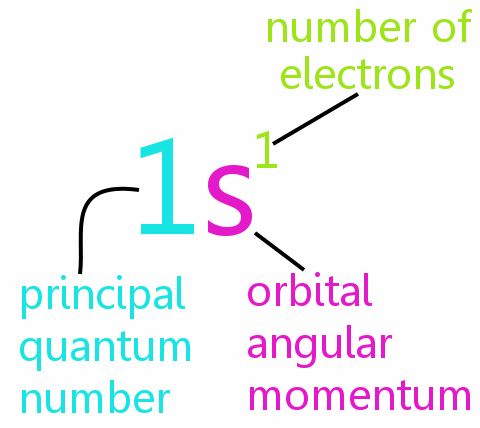
Quattro numeri quantici
Ogni elettrone in un atomo può essere definito completamente da quattro numeri quantici:
• n: il numero quantico principale
• l: il numero quantico del momento angolare orbitale
• ml: il numero quantico magnetico
• ms: il numero quantico di spin
Esempio di esclusione di Pauli Principio
Considera la configurazione elettronica dellargon:
Il principio di esclusione afferma che ogni elettrone in un atomo di argon si trova in uno stato unico.
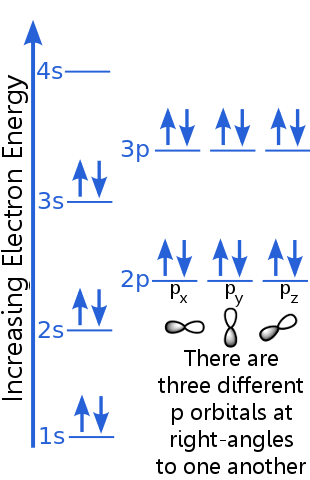
Il livello 1s può ospitare due elettroni con numeri quantici n, l e ml identici.Argon “s la coppia di elettroni nellorbitale 1s soddisfa il principio di esclusione perché hanno spin opposti, il che significa che hanno numeri quantici di spin diversi, ms. Uno spin è + ½, laltro è -½. (Invece di dire + ½ o -½ spesso si dice che gli elettroni siano spin-up ![]() o spin-down
o spin-down ![]() .)
.)
Gli elettroni di livello 2s hanno un numero quantico principale diverso da quelli nellorbitale 1s. La coppia di elettroni 2s differisce tra loro perché hanno spin opposti.
Gli elettroni di livello 2p hanno un numero di momento angolare orbitale diverso da quelli negli orbitali s, da cui la lettera p piuttosto che s. Ci sono tre orbitali p di uguale energia, px, py e pz. Gli orbitali sono diversi luno dallaltro perché hanno orientamenti diversi nello spazio. Ciascuno degli orbitali px, py e pz può ospitare una coppia di elettroni con spin opposti.
Il livello 3s sale a un numero quantico principale più alto ; questo orbitale ospita una coppia di elettroni con spin opposti.
La descrizione del livello 3p è simile a quella per 2p, ma il numero quantico principale è più alto: 3p si trova a unenergia superiore a 2p.
Definizione generale del principio di esclusione di Pauli
Gli elettroni appartengono a unampia classe di particelle subatomiche chiamate fermioni. I fermioni hanno il quanto di spin numeri con valori semi interi.
I quark (su e giù) e i leptoni (elettroni, neutrini elettronici, muoni, neutrini muonici, tau e neutrini tau) sono tutti fermioni.
Tutti i fermioni e le particelle derivati da fermioni, come protoni e neutroni, obbediscono alle statistiche di Fermi-Dirac; questo include lobbedienza al principio di esclusione di Pauli.
Il principio di esclusione di Pauli dice che non esistono due fermioni identici che possono occupare simultaneamente lo stesso stato quantistico.
Il principio di esclusione di Pauli non si applica ai bosoni: si tratta di particelle che obbediscono alle statistiche di Bose-Einstein; tutte hanno valori interi di spin. I fotoni, i gluoni, i gravitoni ei bosoni W, Z e di Higgs sono tutti bosoni.
