Definition des Pauli-Ausschlussprinzips
Chemie Definition des Pauli-Ausschlussprinzips
Das Pauli-Ausschlussprinzip besagt, dass jedes Elektron sein muss Mit anderen Worten, keine Elektronen in einem Atom dürfen einen identischen Satz von Quantenzahlen haben.

Die Das Pauli-Ausschlussprinzip steht im Zentrum der Chemie und hilft, die Elektronenanordnungen in Atomen und Molekülen zu erklären und Muster im Periodensystem zu rationalisieren.
In der Chemie wird das Pauli-Ausschlussprinzip ausschließlich auf Elektronen angewendet. Das werden wir gleich diskutieren.
Wolfgang Pauli erhielt 1945 den Nobelpreis für Physik für seine Entdeckung in Bezug auf Elektronen.
Später wurde festgestellt, dass das Pauli-Ausschlussprinzip eine breitere Bedeutung hatDies bedeutet, dass wir am Ende dieser Seite erwähnen werden.
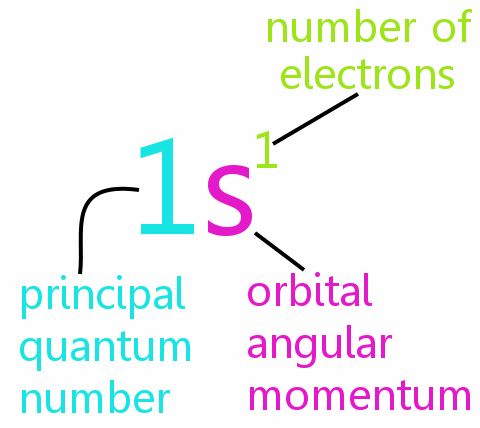
Vier Quantenzahlen
Jedes Elektron in einem Atom kann vollständig durch vier Quantenzahlen definiert werden:
• n: die Hauptquantenzahl
• l: die Umlaufdrehimpulsquantenzahl
• ml: die magnetische Quantenzahl
• ms: die Spinquantenzahl
Beispiel für den Pauli-Ausschluss Prinzip
Betrachten Sie die Elektronenkonfiguration von Argon:
Das Ausschlussprinzip besagt, dass jedes Elektron in einem Argonatom befindet sich in einem eindeutigen Zustand.
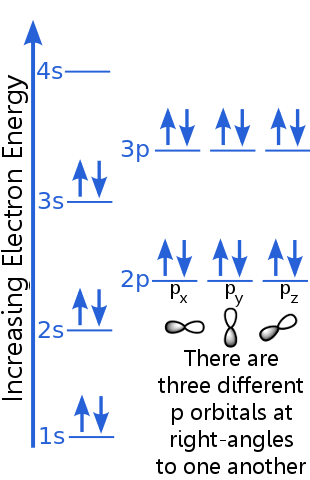
Das 1s-Niveau kann zwei Elektronen mit identischen n-, l- und ml-Quantenzahlen aufnehmen Elektronenpaare im 1s-Orbital erfüllen das Ausschlussprinzip, weil sie entgegengesetzte Spins haben, was bedeutet, dass sie unterschiedliche Spinquantenzahlen haben, ms. Ein Spin ist + ½, der andere ist -½. (Anstatt + ½ oder -½ zu sagen, werden die Elektronen oft als Spin-up ![]() oder Spin-down
oder Spin-down ![]() .)
.)
Die Elektronen auf 2s-Ebene haben eine andere Hauptquantenzahl als im 1s-Orbital. Das 2s-Elektronenpaar unterscheidet sich voneinander, weil sie entgegengesetzte Spins haben.
Die 2p-Elektronen haben eine andere Drehimpulszahl als die in den s-Orbitalen, daher der Buchstabe p anstelle von s. Es gibt drei p-Orbitale gleicher Energie, px, py und pz Orbitale unterscheiden sich voneinander, weil sie unterschiedliche Orientierungen im Raum haben. Jedes der px-, py- und pz-Orbitale kann ein Elektronenpaar mit entgegengesetzten Spins aufnehmen.
Das 3s-Niveau steigt auf eine höhere Hauptquantenzahl an ;; Dieses Orbital nimmt ein Elektronenpaar mit entgegengesetzten Spins auf.
Die Beschreibung des 3p-Niveaus ähnelt der für 2p, aber die Hauptquantenzahl ist höher: 3p liegt bei einer höheren Energie als 2p.
Allgemeine Definition des Pauli-Ausschlussprinzips
Elektronen gehören zu einer breiten Klasse subatomarer Teilchen, die Fermionen genannt werden. Fermionen haben Spinquanten Zahlen mit halbzahligen Werten.
Quarks (auf und ab) und Leptonen (Elektronen, Elektronenneutrinos, Myonen, Myonenneutrinos, Taus und Tau-Neutrinos) sind alle Fermionen.
Alle von Fermionen abgeleiteten Fermionen und Teilchen wie Protonen und Neutronen befolgen die Fermi-Dirac-Statistik, einschließlich der Einhaltung des Pauli-Ausschlussprinzips.
Das Pauli-Ausschlussprinzip besagt, dass keine zwei identischen Fermionen gleichzeitig dieselbe besetzen können Quantenzustand.
Das Pauli-Ausschlussprinzip gilt nicht für Bosonen: Dies sind Teilchen, die der Bose-Einstein-Statistik gehorchen, sie alle haben ganzzahlige Werte für Spin. Photonen, Gluonen, Gravitonen und die Bosonen W, Z und Higgs sind alle Bosonen.
