Definición del principio de exclusión de Pauli
Definición química del principio de exclusión de Pauli
El principio de exclusión de Pauli dice que cada electrón debe ser en su propio estado único. En otras palabras, ningún electrón en un átomo puede tener un conjunto idéntico de números cuánticos.

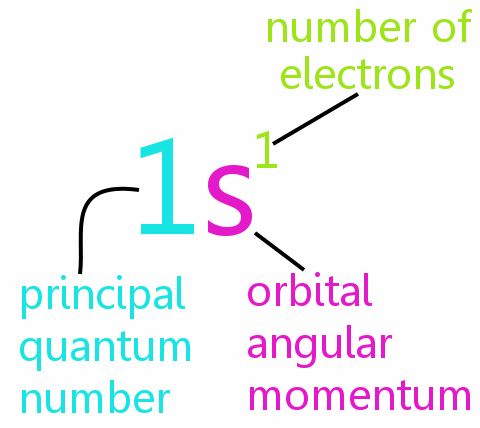
El El principio de exclusión de Pauli se encuentra en el corazón de la química, ayudando a explicar los arreglos de electrones en átomos y moléculas, y ayudando a racionalizar los patrones en la tabla periódica.
En química, el principio de exclusión de Pauli se aplica únicamente a los electrones, que estamos a punto de discutir.
Wolfgang Pauli recibió el Premio Nobel de Física en 1945 por su descubrimiento aplicado a los electrones.
Más tarde se descubrió que el principio de exclusión de Pauli tenía unsignificado, que mencionaremos al final de esta página.
Cuatro números cuánticos
Cada electrón en un átomo se puede definir completamente por cuatro números cuánticos:
• n: el número cuántico principal
• l: el número cuántico del momento angular orbital
• ml: el número cuántico magnético
• ms: el número cuántico de espín
Ejemplo de la exclusión de Pauli Principio
Considere la configuración electrónica del argón:
El principio de exclusión afirma que cada electrón en un átomo de argón está en un estado único.
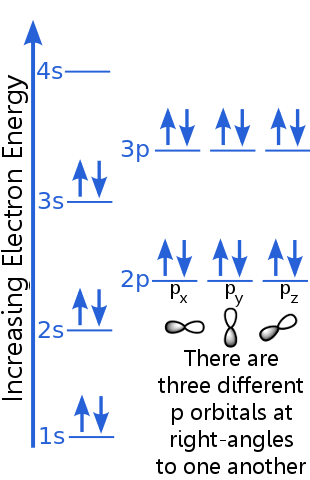
El nivel de 1s puede acomodar dos electrones con números cuánticos n, l y ml idénticos. Argon «s par de electrones en el orbital 1s satisfacen el principio de exclusión porque tienen espines opuestos, lo que significa que tienen diferentes números cuánticos de espín, ms. Un giro es + ½, el otro es -½. (En lugar de decir + ½ o -½, a menudo se dice que los electrones son spin-up ![]() o spin-down
o spin-down ![]() .)
.)
Los electrones del nivel 2s tienen un número cuántico principal diferente a los del orbital 1s. El par de electrones 2s difieren entre sí porque tienen espines opuestos.
Los electrones de nivel 2p tienen un número de momento angular orbital diferente al de los orbitales s, de ahí la letra p en lugar de s. Hay tres orbitales p de igual energía, px, py y pz. Los orbitales son diferentes entre sí porque tienen diferentes orientaciones en el espacio. Cada uno de los orbitales px, py y pz puede acomodar un par de electrones con espines opuestos.
El nivel 3s se eleva a un número cuántico principal más alto ; este orbital aloja un par de electrones con espines opuestos.
La descripción del nivel 3p es similar a la de 2p, pero el número cuántico principal es mayor: 3p se encuentra a una energía superior a 2p.
Definición general del principio de exclusión de Pauli
Los electrones pertenecen a una amplia clase de partículas subatómicas llamadas fermiones. Los fermiones tienen espín cuántico números con valores de medio entero.
Los quarks (arriba y abajo) y los leptones (electrones, neutrinos electrónicos, muones, neutrinos muones, taus y neutrinos tau) son todos fermiones.
Todos los fermiones y partículas derivadas de fermiones, como protones y neutrones, obedecen a las estadísticas de Fermi-Dirac; esto incluye obedecer el principio de exclusión de Pauli.
El principio de exclusión de Pauli dice que no hay dos fermiones idénticos que puedan ocupar simultáneamente el mismo estado cuántico.
El principio de exclusión de Pauli no se aplica a los bosones: son partículas que obedecen a las estadísticas de Bose-Einstein; todas tienen valores enteros de espín. Fotones, gluones, gravitones y los bosones W, Z y Higgs son todos bosones.
