パウリの排他原理の定義
パウリの排他原理の化学の定義
パウリの排他原理は、すべての電子がつまり、原子内の電子が同一の量子数のセットを持つことは許可されていません。

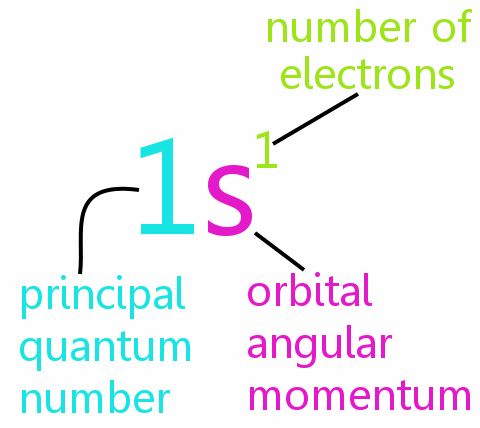
パウリの排他原理は化学の中心に位置し、原子や分子の電子配置を説明し、周期表のパターンを合理化するのに役立ちます。
化学では、パウリの排他原理は電子にのみ適用されます。これについては、これから説明します。
ウォルフガングパウリは、電子に適用された発見により、1945年のノーベル物理学賞を受賞しました。
後に、パウリの排他原理の方が広いことがわかりました。これは、このページの最後で説明します。
4つの量子数
原子内のすべての電子は、4つの量子数で完全に定義できます。
•n:主量子数
•l:軌道角運動量量子数
•ml:磁気量子数
•ms:スピン量子数
パウリ排除の例原理
アルゴンの電子配置を検討する:
除外原理は、すべての電子がアルゴン原子は固有の状態にあります。
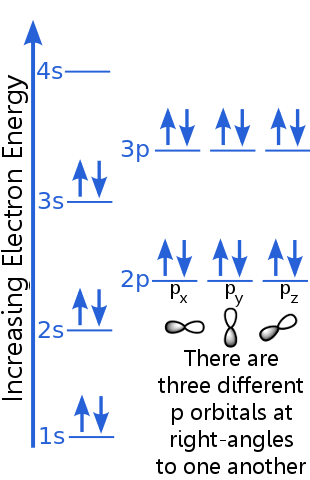
1sレベルは、同じn、l、およびml量子数を持つ2つの電子に対応できます。 1s軌道の電子のペアは、反対のスピンを持っているため、除外の原則を満たしています。つまり、スピン量子数msが異なります。一方のスピンは+½、もう一方は-½です(+½または-½と言う代わりに、電子はスピンアップ![]() またはスピンダウン
またはスピンダウン
。)
2sレベルの電子は、1s軌道の電子とは主量子数が異なります。2s電子のペアは、スピンが反対であるため、互いに異なります。
2pレベルの電子は、s軌道とは異なる軌道角運動量数を持っているため、sではなくpの文字になります。同じエネルギーの3つのp軌道、px、py、pzがあります。これらは軌道は空間内での向きが異なるため、互いに異なります。px、py、pz軌道はそれぞれ、反対のスピンを持つ電子のペアに対応できます。
3sレベルはより高い主量子数に上昇します。 ;この軌道は、反対のスピンを持つ電子対に対応します。
3pレベルの説明は2pの説明と似ていますが、主量子数が高くなります。3pは2pよりも高いエネルギーにあります。
パウリの排他原理の一般的な定義
電子は、フェルミ粒子と呼ばれる幅広いクラスの亜原子粒子に属します。フェルミ粒子にはスピン量子があります。半整数値の数。
クォーク(上下)とレプトン(電子、電子ニュートリノ、ミューオン、ミューオンニュートリノ、タウス、タウニュートリノ)はすべてフェルミ粒子です。
陽子や中性子など、フェルミ粒子に由来するすべてのフェルミ粒子と粒子は、フェルミ-ディラック統計に従います。これには、パウリの排他原理に従うことも含まれます。
パウリの排他原理では、2つの同一のフェルミ粒子が同時に同じを占めることはできません。量子状態。
パウリの排他原理はボソンには適用されません。これらはボーズ-アインシュタイン統計に従う粒子であり、すべてスピンの整数値を持ちます。フォトン、グルーオン、重力子、およびW、Z、ヒッグス粒子はすべてボソンです。
