Definitie van het Pauli-uitsluitingsprincipe
Chemistry Definition of Paulis Exclusion Principle
Het Pauli-uitsluitingsprincipe zegt dat elk elektron in zijn eigen unieke staat. Met andere woorden, elektronen in een atoom mogen geen identieke reeks kwantumgetallen hebben.

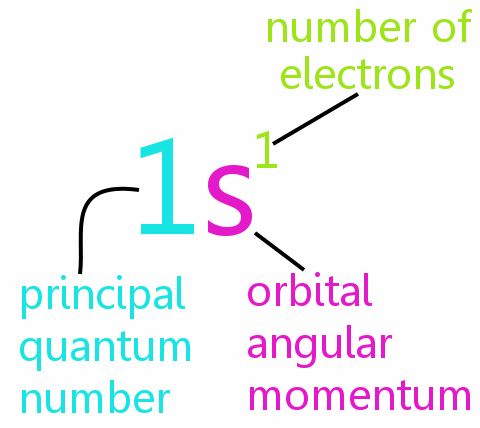
De Het Pauli-uitsluitingsprincipe vormt de kern van de chemie, helpt bij het verklaren van de elektronenrangschikkingen in atomen en moleculen en helpt patronen in het periodiek systeem te rationaliseren.
In de chemie wordt het Pauli-uitsluitingsprincipe uitsluitend toegepast op elektronen, die we op het punt staan te bespreken.
Wolfgang Pauli ontving de Nobelprijs voor natuurkunde in 1945 voor zijn ontdekking zoals die van toepassing was op elektronen.
Later bleek dat het uitsluitingsprincipe van Pauli een brederebetekenis, die we aan het einde van deze pagina zullen noemen.
Vier kwantumgetallen
Elk elektron in een atoom kan volledig worden gedefinieerd door vier kwantumgetallen:
• n: het hoofdkwantumnummer
• l: het baanimpulsmomentkwantumnummer
• ml: het magnetische kwantumnummer
• ms: het spinkwantumnummer
Voorbeeld van de Pauli-uitsluiting Principe
Overweeg de elektronenconfiguratie van argon:
Het uitsluitingsprincipe stelt dat elk elektron in een argon-atoom bevindt zich in een unieke toestand.
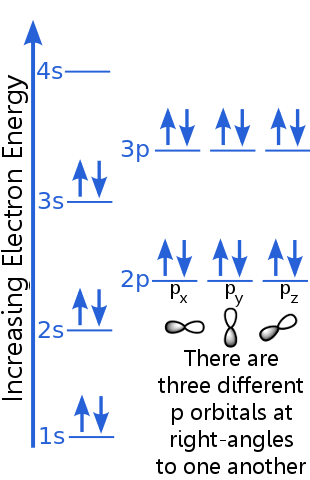
Het 1s-niveau kan twee elektronen met identieke n-, l- en ml-kwantumgetallen herbergen. paar elektronen in de 1s-orbitaal voldoen aan het uitsluitingsprincipe omdat ze tegengestelde spins hebben, wat betekent dat ze verschillende spinkwantumgetallen hebben, ms. De ene spin is + ½, de andere is -½. (In plaats van + ½ of -½ te zeggen, wordt er vaak gezegd dat de elektronen spin-up ![]() of spin-down
of spin-down ![]() .)
.)
De elektronen op het 2s-niveau hebben een ander hoofdkwantumgetal dan die in de 1s-orbitaal. Het paar 2s-elektronen verschilt van elkaar omdat ze tegengestelde spins hebben.
De elektronen op 2p-niveau hebben een ander orbitaal impulsmomentgetal dan die in de s-orbitalen, vandaar de letter p in plaats van s. Er zijn drie p-orbitalen met dezelfde energie, de px, py en pz. orbitalen verschillen van elkaar omdat ze verschillende oriëntaties in de ruimte hebben. Elk van de px-, py- en pz-orbitalen is geschikt voor een paar elektronen met tegengestelde spins.
Het 3s-niveau stijgt naar een hoger hoofdkwantumgetal ; deze orbitaal herbergt een elektronenpaar met tegengestelde spins.
De beschrijving van het 3p-niveau is vergelijkbaar met die voor 2p, maar het belangrijkste kwantumgetal is hoger: 3p ligt op een hogere energie dan 2p.
Algemene definitie van het Pauli-uitsluitingsprincipe
Elektronen behoren tot een brede klasse van subatomaire deeltjes die fermionen worden genoemd. Fermionen hebben spinkwantum getallen met halve gehele getallen.
Quarks (omhoog en omlaag) en leptonen (elektronen, elektronenneutrinos, muonen, muon-neutrinos, taus- en tau-neutrinos) zijn allemaal fermionen.
Alle fermionen en deeltjes afgeleid van fermionen, zoals protonen en neutronen, gehoorzamen aan Fermi-Dirac-statistieken; dit omvat het gehoorzamen aan het Pauli-uitsluitingsprincipe.
Het Pauli-uitsluitingsprincipe zegt dat geen twee identieke fermionen tegelijkertijd hetzelfde kunnen bezetten. kwantumtoestand.
Het Pauli-uitsluitingsprincipe is niet van toepassing op bosonen: dit zijn deeltjes die voldoen aan de Bose-Einstein-statistieken; ze hebben gehele waarden van spin. Fotonen, gluonen, gravitonen en de W-, Z- en Higgs-bosonen zijn allemaal bosonen.
