Definition av Pauli-uteslutningsprincipen
Kemi Definition av Paulis uteslutningsprincip
Pauli-uteslutningsprincipen säger att varje elektron måste vara i sitt eget unika tillstånd. Med andra ord får inga elektroner i en atom ha en identisk uppsättning kvantnummer.

The Pauli-uteslutningsprincipen ligger i hjärtat av kemin och hjälper till att förklara elektronarrangemangen i atomer och molekyler och hjälper till att rationalisera mönster i det periodiska systemet.
I kemi tillämpas Pauli-uteslutningsprincipen enbart på elektroner, som vi håller på att diskutera.
Wolfgang Pauli fick Nobelpriset i fysik 1945 för sin upptäckt när det gällde elektroner.
Senare befanns principen om uteslutning av Pauli ha en bredarevilket vi kommer att nämna i slutet av denna sida.
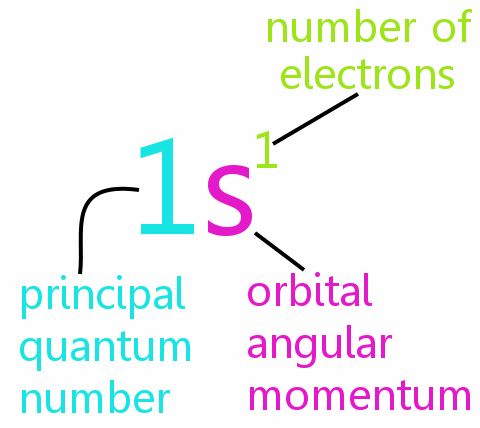
Fyra kvantnummer
Varje elektron i en atom kan definieras fullständigt med fyra kvantnummer:
• n: huvudkvantantalet
• l: det orbitala vinkelmomentkvantantalet
• ml: det magnetiska kvantantalet
• ms: rotationskvantantalet
Exempel på Pauli-uteslutning Princip
Tänk på argons elektronkonfiguration:
Uteslutningsprincipen hävdar att varje elektron i en argonatom är i ett unikt tillstånd.
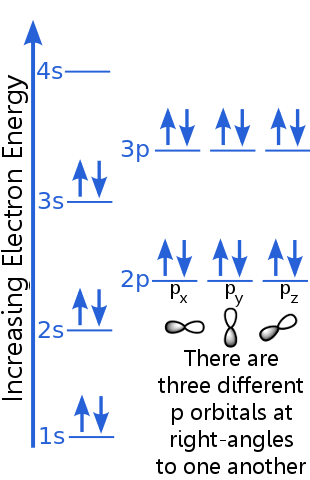
1s-nivån kan rymma två elektroner med identiska n-, l- och ml-kvantnummer. Argon ”s elektronpar i 1s-omloppet uppfyller uteslutningsprincipen eftersom de har motsatta snurr, vilket betyder att de har olika snurrkvanttal, ms. En snurrning är + ½, den andra är -½. (I stället för att säga + ½ eller -½ sägs ofta att elektronerna är snurra upp ![]() eller snurra ner
eller snurra ner ![]() .)
.)
Elektronerna för 2-nivåer har ett annat huvudkvantantal än de i 1-orbitalet. 2-elektronernas par skiljer sig från varandra eftersom de har motsatta snurr.
Elektronerna på 2p-nivå har ett annat antal vinkelmoment i omloppsbana än de i s-orbitalerna, därav bokstaven p snarare än s. Det finns tre p-orbitaler med lika energi, px, py och pz. Dessa orbitaler skiljer sig från varandra eftersom de har olika orienteringar i rymden. Var och en av px-, py- och pz-orbitalerna kan rymma ett par elektroner med motsatta snurr. ; detta omlopp rymmer ett elektronpar med motsatta snurr.
Beskrivningen av 3p-nivån liknar den för 2p, men huvudkvantantalet är högre: 3p ligger vid en högre energi än 2p.
Allmän definition av Pauli-uteslutningsprincipen
Elektroner tillhör en bred klass av subatomära partiklar som kallas fermioner. Fermioner har snurrkvantum siffror med halva heltal.
Kvarker (upp och ner) och leptoner (elektroner, elektronneutriner, muoner, muonneutriner, taus och tau-neutriner) är alla fermioner.
Alla fermioner och partiklar härledda från fermioner, såsom protoner och neutroner, följer Fermi-Dirac-statistiken; detta inkluderar att följa Pauli-uteslutningsprincipen.
Pauli-uteslutningsprincipen säger att inga två identiska fermioner samtidigt kan uppta samma kvanttillstånd.
Pauli-uteslutningsprincipen gäller inte för bosoner: dessa är partiklar som följer Bose-Einstein-statistiken; de alla har helvärden av spin. Foton, gluoner, gravitoner och W-, Z- och Higgs-bosonerna är alla bosoner.
