Definição do Princípio de Exclusão de Pauli
Definição de Química do Princípio de Exclusão de Pauli
O princípio de exclusão de Pauli diz que todo elétron deve ser em seu próprio estado único. Em outras palavras, nenhum elétron em um átomo pode ter um conjunto idêntico de números quânticos.

O O princípio de exclusão de Pauli está no cerne da química, ajudando a explicar os arranjos de elétrons em átomos e moléculas e ajudando a racionalizar padrões na tabela periódica.
Em química, o princípio de exclusão de Pauli é aplicado apenas aos elétrons, que estamos prestes a discutir.
Wolfgang Pauli recebeu o Prêmio Nobel de Física de 1945 por sua descoberta aplicada aos elétrons.
Mais tarde, descobriu-se que o princípio de exclusão de Pauli tinha uma visão mais amplasignificado, que mencionaremos no final desta página.
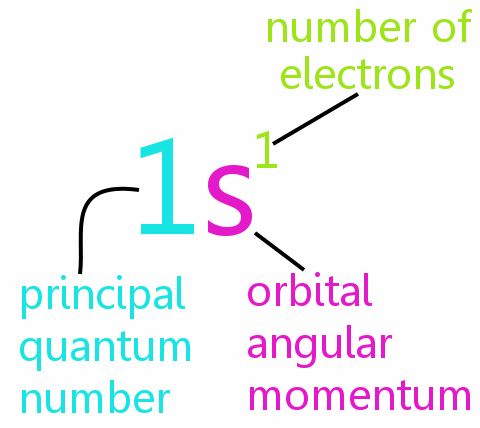
Quatro números quânticos
Cada elétron em um átomo pode ser definido completamente por quatro números quânticos:
• n: o número quântico principal
• l: o número quântico do momento angular orbital
• ml: o número quântico magnético
• ms: o número quântico de spin
Exemplo da exclusão de Pauli Princípio
Considere a configuração do elétron do argônio:
O princípio de exclusão afirma que todo elétron em um átomo de argônio está em um estado único.
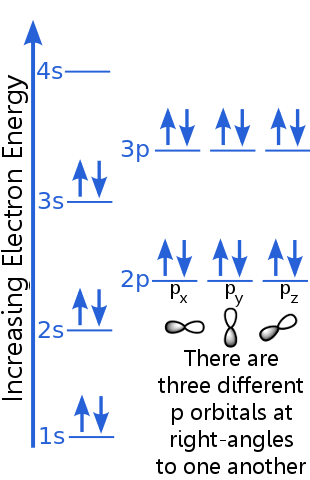
O nível 1s pode acomodar dois elétrons com números quânticos idênticos n, l e ml.Argon “s O par de elétrons no orbital 1s satisfaz o princípio de exclusão porque têm spins opostos, o que significa que têm números quânticos de spin diferentes, ms. Um spin é + ½, o outro é -½. (Em vez de dizer + ½ ou -½, costuma-se dizer que os elétrons são spin-up ![]() ou spin-down
ou spin-down ![]() .)
.)
Os elétrons de nível 2s têm um número quântico principal diferente daqueles no orbital 1s. O par de elétrons 2s difere um do outro porque têm spins opostos.
Os elétrons de nível 2p têm um número de momento angular orbital diferente daqueles nos orbitais s, daí a letra p em vez de s. Existem três orbitais p de energia igual, px, py e pz. os orbitais são diferentes uns dos outros porque têm orientações diferentes no espaço. Cada um dos orbitais px, py e pz pode acomodar um par de elétrons com spins opostos.
O nível 3s sobe para um número quântico principal mais alto ; este orbital acomoda um par de elétrons com spins opostos.
A descrição do nível 3p é semelhante à de 2p, mas o número quântico principal é maior: 3p está em uma energia maior que 2p.
Definição geral do princípio de exclusão de Pauli
Os elétrons pertencem a uma ampla classe de partículas subatômicas chamadas férmions. Os férmions têm spin quântico números com valores de meio inteiro.
Quarks (para cima e para baixo) e léptons (elétrons, neutrinos de elétrons, múons, neutrinos de múons, taus e neutrinos de tau) são todos férmions.
Todos os férmions e partículas derivados de férmions, como prótons e nêutrons, obedecem às estatísticas de Fermi-Dirac; isso inclui obedecer ao princípio de exclusão de Pauli.
O princípio de exclusão de Pauli diz que dois férmions idênticos não podem ocupar simultaneamente o mesmo estado quântico.
O princípio de exclusão de Pauli não se aplica a bósons: são partículas que obedecem às estatísticas de Bose-Einstein; todas têm valores inteiros de spin. Fótons, glúons, grávitons e os bósons W, Z e Higgs são todos bósons.
