a Pauli kizárási elv meghatározása
a Pauli kizárási elvének kémiai meghatározása
A Pauli kizárási elv szerint minden elektronnak saját egyedi állapotában. Más szavakkal, az atomokban egyetlen elektronnak sem megengedett azonos kvantumszám-halmaza.

A Pauli kizárási elv a kémia középpontjában áll, segít megmagyarázni az atomokban és molekulákban található elektronelrendezéseket, és segít a periódusos rendszer mintáinak ésszerűsítésében. amelyet hamarosan megvitatunk.
Wolfgang Pauli az 1945-ös fizikai Nobel-díjat kapta az elektronokra vonatkozó felfedezéséért.
Később kiderült, hogy a Pauli kizárási elv szélesebb körűjelentése, amelyet az oldal végén megemlítünk.
Négy kvantumszám
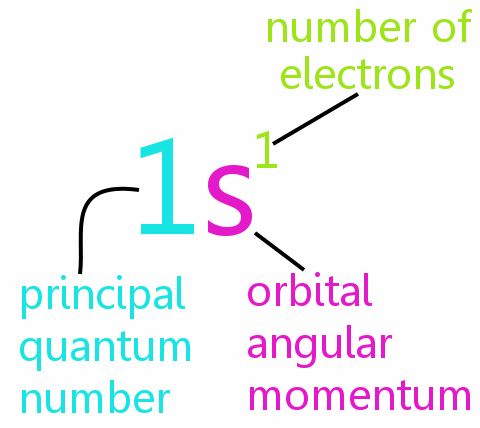
Az atom minden elektront négy kvantumszámmal határozhat meg teljesen:
• n: az elsődleges kvantumszám
• l: az orbitális szögmomentum kvantumszám
• ml: a mágneses kvantumszám
• ms: a spin-kvantumszám
Példa a Pauli-kizárásra Alapelv
Fontolja meg az argon elektronkonfigurációját:
A kizárási elv azt állítja, hogy minden elektron egy argonatom egyedi állapotban van.
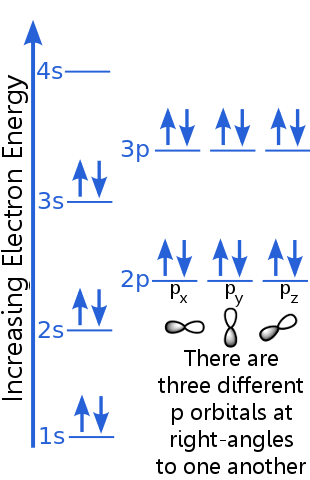
Az 1s szint két olyan elektron befogadására képes, amelyek azonos n, l és ml kvantumszámmal rendelkeznek. az 1s pályán lévő elektronpár kielégíti a kizárási elvet, mert ellentétes pörgetésekkel rendelkeznek, vagyis különböző spin-kvantumszámokkal, ms. Az egyik spin + ½, a másik -½. (Ahelyett, hogy gyakran mondanánk a + ½ vagy -½ szót, az elektronokat spin-up ![]() vagy spin-down
vagy spin-down ![]() .)
.)
A 2-es szintű elektronok fő kvantumszáma eltér az 1-es pályán lévőktől. A 2-es elektronpár különbözik egymástól, mert ellentétes pörgetéssel rendelkeznek.
A 2p szintű elektronok orbitális szögimpulzus-száma eltér az s pályákéitól, ezért a p betű helyett az s. Három egyenlő energiájú p pálya létezik, a px, py és pz. Ezek a pályák különböznek egymástól, mert a térben különböző irányúak. A px, py és pz pályák mindegyikébe be lehet férni egy ellentétes pörgésű elektronpárral.
A 3s szint magasabb fő kvantumszámra emelkedik ; ez a pálya egy ellentétes pörgésű elektronpárt képes befogadni.
A 3p-szint leírása hasonló a 2p-hez, de a fő kvantumszám magasabb: 3p nagyobb energiával fekszik, mint 2p. >
A Pauli kizárási elv általános meghatározása
Az elektronok a szubatomi részecskék széles osztályába tartoznak, az úgynevezett fermionok. fél egész értékű számok.
A kvarkok (fel és le) és a leptonok (elektronok, elektron-neutrínók, müonok, müon-neutrínók, tausok és tau-neutrínók) mind fermionok.
Az összes fermion és a fermionból származó részecske, például a protonok és a neutronok, engedelmeskednek a Fermi-Dirac statisztikáknak; ide tartozik a Pauli kizárási elvének való megfelelés is. kvantumállapot.
A Pauli kizárási elv nem vonatkozik a bozonokra: ezek olyan részecskék, amelyek engedelmeskednek a Bose-Einstein statisztikáknak; a spin értéke egész. A fotonok, a gluonok, a gravitonok, valamint a W, Z és Higgs bozonok egyaránt bozonok.
