Gruppe 14: Generelle egenskaber og reaktioner
Carbon
Carbon er det fjerde mest forekommende element på jorden. Det er af særlig interesse i organisk kemi, da det er det kendetegnende ved en organisk forbindelse. Det betragtes også som “rygraden” i biologien, da alle livsformer på jorden er kulstofbaserede. Dette skyldes to vigtige kulstofkvaliteter: dens lille størrelse og dens unikke elektronkonfiguration. Fordi kulstofatomer er små, overlapper deres p-orbitalelektroner betydeligt og muliggør dannelse af π-bindinger. Sammenlign nedenstående molekylære strukturer af CO2 og SiO2:
Carbon “s elektronkonfiguration af gør det muligt at danne meget stabile bindinger med ilt og brint. Disse bindinger gemmer en enorm mængde energi. Dannelsen (fiksering) og brud (forbrænding) af disse bindinger i kulstofcyklussen letter det jordiske liv:
- Carbonfiksering: I fotosyntese, planter bruger energi fra solen og klorofylmolekyler til at omdanne gasformig kuldioxid fra atmosfæren til enkle kulhydrater som glukose:
\
- Forbrænding af kulstof: I aerob respiration nedbryder planter og dyr kulhydrater ned i kuldioxid og vand (som vist i ligningen nedenfor) og bruger den frigivne energi til at brænde biologiske aktiviteter – vækst , bevægelse osv. Desuden giver forbrændingen af kulhydrater, der findes i fossile brændstoffer, den energi, der er nødvendig til moderne aktiviteter.
\
Ved siden af svovl er kulstof det element, der har flest allotrope. Kulstof har tre vigtigste solid state allotroper: grafit, diamant og fullerener (den mest kendte af dem, buckminsterfulleren, er også kendt som en “buckyball”). Disse allotroper adskiller sig meget i struktur, men bruges i vid udstrækning i moderne produktion.
Grafit og en diamant
Grafit har smøreegenskaber, der gør den yderst velegnet til brug i blyanter. Fordi den består af planer med seks-leddede ringe, der let kan glide forbi hinanden, glider grafit let og bruges derfor i kombination med ler til at danne blyant “bly”. Grafit bruges også i fiberform til forskellige plastmaterialer.
Kulstof har meget høje smelte- og kogepunkter. Grafit er den mest termodynamisk stabile allotrop af kulstof under normale forhold. I diamant, den mere stabile allotrop ved ekstreme tryk (105 atm og op), er hvert carbonatom bundet til fire andre i et tetraedrisk arrangement, hvilket resulterer i det hårdeste naturligt forekommende stof, der er kendt. Denne hårdhed kombineret med en god evne til at sprede varme gør diamant- og diamantfilm til fremragende materialer i bor og andre maskindele; dog anvendes de højeste kvalitets naturlige diamanter hovedsageligt til smykker, mens diamanter af lavere kvalitet eller endda syntetisk diamant bruges til industrielle formål.
Fullerenes (opkaldt efter R. Buckminster Fuller) og nanorør er en serie af kulstofallotroper, hvor kulstofringe danner mere komplekse former, herunder fodboldboldlignende molekyler (C60) og rør, der ligner cylindre lavet af kyllingetråd. Grafen, et enkelt kulstofark med spændende elektroniske egenskaber, er grundlaget for disse allotroper. Fullerener opstår, når en bestemt procentdel af sekskantede ringe samles til dannelse af femkantede ringe, hvilket får arket til at krumme ud i en omtrent sfærisk “Buckyball”. Et kulstofnanorør er simpelthen grafen bøjet ind i en cylinder. Nogle af disse allotroper dannes ved nedbrydning af grafit. Forbrænding kan også give alternative kulstofformer. Opvarmet kul uden luft danner koks. Tilsvarende opvarmet træ bliver trækul, når mere flygtige integrander tvinges væk.

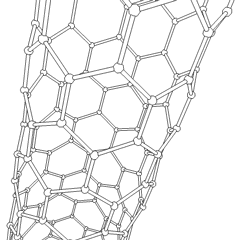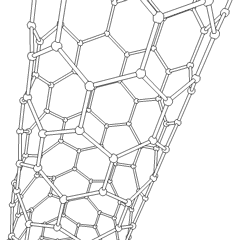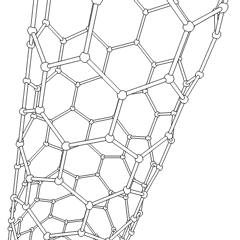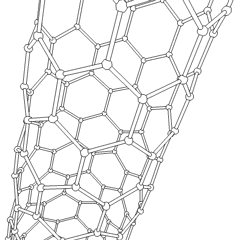
Der er en næsten utallig mængde forskellige carbonforbindelser, men adskillige uorganiske forbindelser er særligt vigtige. Kulilte (CO) bruges til at syntetisere andre kulstofforbindelser, reducere metalforbindelser til brugbare produkter og i kombination med andre gasser til brændstof. Carbider, forbindelser af kulstof og metaller, anvendes i mange industrielle processer, ofte til at stabilisere andre metalstrukturer; calciumcarbid bruges f.eks. til at fremstille industrielle kemiske forbindelser. Carbondisulfid og carbontetrachlorid er stærke opløsningsmidler (selvom brugen af CCl4 siden dets klassificering som kræftfremkaldende er faldet). Cyanid opfører sig på samme måde som halogenioner og danner både et salt og en syre. Hydrocyansyre (HCN) er en svag syre med et ekstremt lavt kogepunkt (faktisk stuetemperatur) og bruges i plastproduktion.En cyanid dimer kaldes et cyanogen, og det bruges i organiske synteser, fumiganter og raketdrivmiddel.