Gruppe 14: Allgemeine Eigenschaften und Reaktionen
Kohlenstoff
Kohlenstoff ist das vierthäufigste Element auf der Erde. Es ist von besonderem Interesse für die organische Chemie, da es das Unterscheidungsmerkmal einer organischen Verbindung ist. Es wird auch als „Rückgrat“ der Biologie angesehen, da alle Lebensformen auf der Erde auf Kohlenstoff basieren. Dies ist auf zwei wichtige Eigenschaften von Kohlenstoff zurückzuführen: seine geringe Größe und seine einzigartige Elektronenkonfiguration. Da Kohlenstoffatome klein sind, überlappen sich ihre p-Orbitalelektronen erheblich und ermöglichen die Bildung von π-Bindungen. Vergleichen Sie die folgenden Molekülstrukturen von CO2 und SiO2:
Die Elektronenkonfiguration von Kohlenstoff ermöglicht es ihm, sehr stabile Bindungen mit zu bilden Sauerstoff und Wasserstoff. Diese Bindungen speichern eine enorme Menge an Energie. Die Bildung (Fixierung) und der Bruch (Verbrennung) dieser Bindungen im Kohlenstoffkreislauf erleichtern das irdische Leben:
- Kohlenstofffixierung: Bei der Photosynthese, Pflanzen nutzen Sonnenenergie und Chlorophyllmoleküle, um gasförmiges Kohlendioxid aus der Atmosphäre in einfache Kohlenhydrate wie Glukose umzuwandeln:
\
- Kohlenstoffverbrennung: Bei der aeroben Atmung zerlegen Pflanzen und Tiere Kohlenhydrate in Kohlendioxid und Wasser (wie in der folgenden Gleichung gezeigt) und nutzen die freigesetzte Energie, um biologische Aktivitäten zu fördern – Wachstum , Bewegung usw. Darüber hinaus liefert die Verbrennung von Kohlenhydraten in fossilen Brennstoffen Energie, die für moderne Aktivitäten benötigt wird.
\
Kohlenstoff ist neben Schwefel das Element mit den meisten Allotropen. Kohlenstoff hat drei Hauptfestkörper-Allotrope: Graphit, Diamant und Fullerene (das bekannteste davon, Buckminsterfulleren, ist auch als „Buckyball“ bekannt). Diese Allotrope unterscheiden sich stark in ihrer Struktur, werden jedoch in der modernen Produktion häufig verwendet.
Graphit und ein Diamant
Graphit hat Schmiereigenschaften, die es für die Verwendung in Stiften äußerst geeignet machen. Da es aus Ebenen von Sechsringen besteht, die leicht aneinander vorbeigleiten können, gleitet Graphit leicht und wird daher in Kombination mit Ton zur Bildung von Bleistift „Blei“ verwendet. Graphit wird auch in faseriger Form für verschiedene Kunststoffe verwendet.
Kohlenstoff hat sehr hohe Schmelz- und Siedepunkte. Graphit ist unter normalen Bedingungen das thermodynamisch stabilste Allotrop von Kohlenstoff. In Diamant, dem stabileren Allotrop bei extremen Drücken (105 atm und mehr), ist jedes Kohlenstoffatom in einer tetraedrischen Anordnung an vier andere gebunden, was zu der härtesten natürlich vorkommenden Substanz führt, die bekannt ist. Diese Härte, kombiniert mit einer guten Fähigkeit, Wärme abzuleiten, macht Diamant und Diamantfilm zu hervorragenden Materialien in Bohrern und anderen Maschinenteilen. Die natürlichen Diamanten von höchster Qualität werden jedoch hauptsächlich für Schmuck verwendet, während minderwertige Diamanten oder sogar synthetische Diamanten für industrielle Zwecke verwendet werden.
Fullerene (benannt nach R. Buckminster Fuller) und Nanoröhren sind eine Reihe von Kohlenstoff-Allotropen, in denen Kohlenstoffringe komplexere Formen bilden, einschließlich fußballähnlicher Moleküle (C60) und Röhren, die Zylindern aus Hühnerdraht ähneln. Graphen, eine einzelne Kohlenstoffschicht mit faszinierenden elektronischen Eigenschaften, ist die Basis für diese Allotrope. Fullerene treten auf, wenn ein bestimmter Prozentsatz sechseckiger Ringe zu fünfeckigen Ringen zusammengesetzt wird, wodurch sich das Blatt zu einem grob kugelförmigen „Buckyball“ verzieht. Eine Kohlenstoffnanoröhre ist einfach Graphen, das in einen Zylinder gebogen ist. Einige dieser Allotrope entstehen bei der Zersetzung von Graphit. Die Verbrennung kann auch alternative Kohlenstoffformen ergeben. Erhitzte Kohle ohne Luft bildet Koks. Ähnlich erhitztes Holz wird zu Holzkohle, wenn flüchtigere Integranden weggedrückt werden.

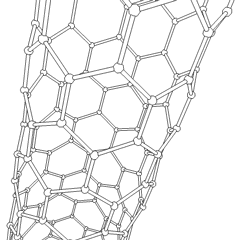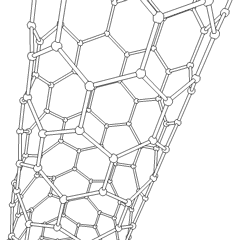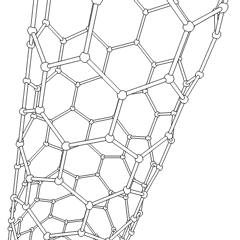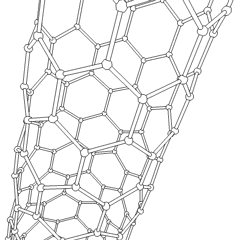
Es gibt Eine nahezu unzählige Menge verschiedener Kohlenstoffverbindungen, aber mehrere anorganische Verbindungen sind besonders wichtig. Kohlenmonoxid (CO) wird zur Synthese anderer Kohlenstoffverbindungen, zur Reduktion von Metallverbindungen zu verwendbaren Produkten und in Kombination mit anderen Gasen als Kraftstoff verwendet. Carbide, Verbindungen von Kohlenstoff und Metallen, werden in vielen industriellen Prozessen verwendet, häufig zur Stabilisierung anderer Metallstrukturen; Calciumcarbid wird beispielsweise zur Herstellung industrieller chemischer Verbindungen verwendet. Schwefelkohlenstoff und Tetrachlorkohlenstoff sind starke Lösungsmittel (obwohl die Verwendung von CCl4 seit seiner Einstufung als krebserregend zurückgegangen ist). Cyanid verhält sich ähnlich wie Halogenidionen und bildet sowohl ein Salz als auch eine Säure. Blausäure (HCN) ist eine schwache Säure mit einem extrem niedrigen Siedepunkt (tatsächlich Raumtemperatur) und wird in der Kunststoffherstellung verwendet.Ein Cyaniddimer wird als Cyan bezeichnet und wird in organischen Synthesen, Begasungsmitteln und Raketentreibstoffen verwendet