Gruppo 14: Proprietà generali e reazioni
Carbonio
Il carbonio è il quarto elemento più abbondante sulla terra. È di particolare interesse per la chimica organica, in quanto è la caratteristica distintiva di un composto organico. È anche considerato la “spina dorsale” della biologia, poiché tutte le forme di vita sulla terra sono a base di carbonio. Ciò è dovuto a due importanti qualità del carbonio: le sue piccole dimensioni e la sua configurazione elettronica unica. Poiché gli atomi di carbonio sono piccoli, i loro elettroni p-orbitali si sovrappongono notevolmente e consentono la formazione di legami π. Confronta le strutture molecolari di CO2 e SiO2 di seguito:
La configurazione elettronica del carbonio gli consente di formare legami molto stabili con ossigeno e idrogeno. Questi legami immagazzinano unenorme quantità di energia. La formazione (fissazione) e la rottura (combustione) di questi legami nel ciclo del carbonio facilitano la vita terrena:
- Fissazione del carbonio: nella fotosintesi, le piante utilizzano lenergia del sole e le molecole di clorofilla per trasformare lanidride carbonica gassosa dellatmosfera in carboidrati semplici come il glucosio:
\
- Combustione del carbonio: nella respirazione aerobica, piante e animali scompongono i carboidrati in anidride carbonica e acqua (come mostrato nellequazione seguente) e usano lenergia rilasciata per alimentare le attività biologiche – crescita , movimento, ecc. Inoltre, la combustione dei carboidrati presenti nei combustibili fossili fornisce lenergia necessaria per le attività moderne.
\
Accanto allo zolfo, il carbonio è lelemento con il maggior numero di allotropi. Il carbonio ha tre principali allotropi allo stato solido: grafite, diamante e fullereni (il più comunemente noto dei quali, il buckminsterfullerene, è anche noto come “buckyball”). Questi allotropi differiscono notevolmente nella struttura ma sono ampiamente utilizzati nella produzione moderna.
Grafite e un diamante
La grafite ha proprietà lubrificanti che la rendono estremamente adatta alluso nelle matite. Poiché è costituita da piani di anelli a sei membri che possono facilmente scorrere luno sullaltro, la grafite scivola facilmente ed è quindi utilizzata in combinazione con largilla per formare la “mina” a matita. La grafite viene anche utilizzata in forma fibrosa per varie plastiche.
Il carbonio ha punti di fusione e di ebollizione molto elevati. La grafite è lallotropo del carbonio più termodinamicamente stabile in condizioni normali. Nel diamante, lallotropo più stabile a pressioni estreme (105 atm e oltre), ogni atomo di carbonio è legato ad altri quattro in una disposizione tetraedrica, risultando nella sostanza naturale più dura conosciuta. Questa durezza, combinata con una buona capacità di dissipare il calore, rende il diamante e la pellicola diamantata ottimi materiali nelle punte da trapano e in altre parti di macchine; tuttavia, i diamanti naturali di altissima qualità vengono utilizzati principalmente per i gioielli, mentre i diamanti di qualità inferiore o persino i diamanti sintetici vengono utilizzati per scopi industriali.
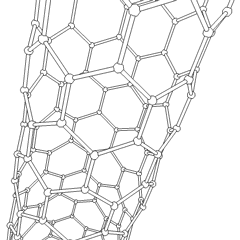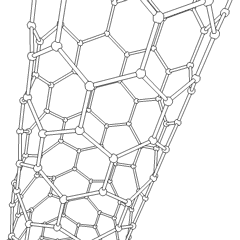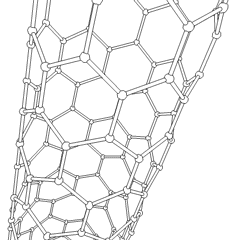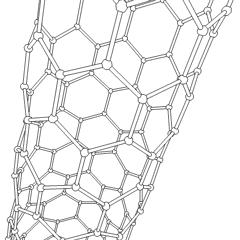
Fullereni (dal nome di R. Buckminster Fuller) e nanotubi sono una serie di allotropi di carbonio in cui gli anelli di carbonio formano forme più complesse, comprese molecole simili a palloni da calcio (C60) e tubi simili a cilindri fatti di filo di pollo. Il grafene, un unico foglio di carbonio con proprietà elettroniche intriganti, è la base di questi allotropi. I fullereni si verificano quando una certa percentuale di anelli esagonali viene assemblata per formare anelli pentagonali, provocando la contorsione del foglio in un “Buckyball” approssimativamente sferico. Un nanotubo di carbonio è semplicemente grafene piegato in un cilindro. Alcuni di questi allotropi si formano nella decomposizione della grafite. La combustione può anche produrre forme di carbonio alternative. Il carbone riscaldato senza aria forma coke. Allo stesso modo la legna riscaldata diventa carbone man mano che gli integrandi più volatili vengono allontanati.

Cè una quantità quasi innumerevole di diversi composti di carbonio, ma diversi composti inorganici sono particolarmente importanti. Il monossido di carbonio (CO) viene utilizzato per sintetizzare altri composti di carbonio, ridurre i composti metallici a prodotti utilizzabili e in combinazione con altri gas per il carburante. I carburi, composti di carbonio e metalli, sono utilizzati in molti processi industriali, spesso per stabilizzare altre strutture metalliche; il carburo di calcio viene utilizzato per fabbricare composti chimici industriali, ad esempio. Il disolfuro di carbonio e il tetracloruro di carbonio sono potenti solventi, (sebbene dalla sua classificazione come cancerogeno, luso di CCl4 sia diminuito). Il cianuro si comporta in modo simile agli ioni alogenuro, formando sia un sale che un acido. Lacido cianidrico (HCN) è un acido debole con un punto di ebollizione estremamente basso (temperatura ambiente appunto) e viene utilizzato nella produzione di plastica.Un dimero di cianuro è chiamato cianogeno e viene utilizzato in sintesi organiche, fumiganti e propellenti per razzi.