14. csoport: Általános tulajdonságok és reakciók
Szén
A szén a földön a negyedik leggyakoribb elem. Különösen érdekes a szerves kémia szempontjából, mivel ez a szerves vegyület megkülönböztető jellemzője. A biológia “gerincének” is tekintik, mivel a földön minden életforma szénalapú. Ez a szén két fontos tulajdonságának köszönhető: kis méretének és egyedi elektronkonfigurációjának. Mivel a szénatomok kicsiek, p-orbitális elektronjaik jelentősen átfedik egymást, és lehetővé teszik a π kötések kialakulását. Hasonlítsa össze az alábbiakban a CO2 és a SiO2 molekulaszerkezetét:
A szén elektronkonfigurációja lehetővé teszi, hogy nagyon stabil kötéseket alakítson ki a oxigén és hidrogén. Ezek a kötések hatalmas mennyiségű energiát tárolnak fel. E kötések kialakulása (rögzítése) és felszakadása (égése) a szén körforgásában megkönnyíti a földi életet: a növények a nap energiáját és a klorofill molekulákat használják arra, hogy a légkörből származó gáznemű szén-dioxidot egyszerű szénhidrátokká, például glükózzá alakítsák:
\
- Szénégetés: Az aerob légzés során a növények és állatok a szénhidrátokat széndioxiddá és vízzé bontják (az alábbi egyenletben látható módon), és a felszabaduló energiát a biológiai tevékenységek – növekedés – üzemanyagára használják fel , mozgás stb. Ezenkívül a fosszilis tüzelőanyagokban található szénhidrátok elégetése biztosítja a modern tevékenységekhez szükséges energiát.
\
A kén mellett a szén a legtöbb allotrópot tartalmazó elem. A szénnek három fő szilárdtest-allotrópja van: grafit, gyémánt és fullerének (amelyek közül a legismertebb, a buckminsterfullerene “buckyball” néven is ismert). Ezek az allotropok felépítésükben nagyban különböznek, de széles körben használják a modern gyártásban.
Grafit és gyémánt
A grafit kenési tulajdonságokkal rendelkezik, amelyek rendkívül alkalmassá teszik ceruzákban történő használatra. Mivel hattagú gyűrűkből álló síkok alkotják, amelyek könnyen elcsúszhatnak egymás mellett, a grafit könnyen csúszik, és ezért agyaggal kombinálva ceruza “ólom” képződik. A grafitot szálas formában különféle műanyagokhoz is használják.
A szén nagyon magas olvadás- és forrásponttal rendelkezik. A grafit a termodinamikailag legstabilabb szén allotrópja szokásos körülmények között. A gyémántban, a stabilabb allotrópban extrém nyomásokon (105 atm és feletti nyomáson), minden szénatom négy másikhoz kötődik tetraéderes elrendezésben, aminek eredményeként a legnehezebben ismert természetes anyag fordul elő. Ez a keménység a hőelvezetés jó képességével kombinálva a gyémántot és a gyémántfilmet kiváló anyaggá teszi fúrófejekben és egyéb gépalkatrészekben; a legjobb minőségű természetes gyémántokat azonban elsősorban ékszerekhez használják, míg az alacsonyabb osztályú gyémántokat vagy akár szintetikus gyémántokat ipari célokra használják.
A Fullerenes (R. Buckminster Fuller nevét viseli) és a nanocsövek sorozat szén-allotrópok, amelyekben a széngyűrűk összetettebb formákat képeznek, beleértve a futball-labdához hasonló molekulákat (C60) és csirkehuzalból készült hengerekre emlékeztető csöveket. A grafén, egyetlen széndioxidlemez, érdekes elektronikus tulajdonságokkal, ezeknek az allotropoknak az alapja. A fullerének akkor fordulnak elő, amikor a hatszögletű gyűrűk bizonyos százaléka ötszögletű gyűrűkké alakul össze, ami a lap durván gömb alakú “Buckyball” -jává torzul. A szén nanocső egyszerűen grafén, hengerbe hajlítva. Ezen allotropok egy része a grafit bomlásakor képződik. Az égetés alternatív szénformákat is eredményezhet. A levegő nélküli fűtött szén kokszot képez. A hasonlóan fűtött fa szénné válik, mivel az illékonyabb integrandok kiszorulnak.

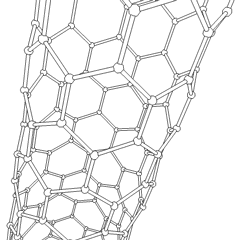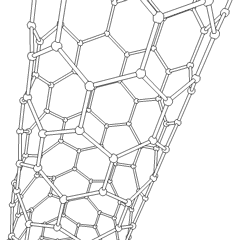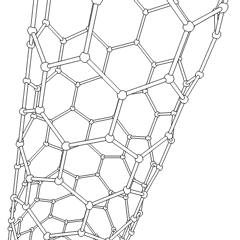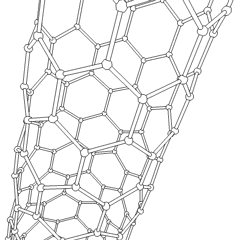
Van közel megszámlálhatatlan mennyiségű különböző szénvegyület, de több szervetlen vegyület különösen fontos. A szén-monoxidot (CO) más szénvegyületek szintetizálására, a fémvegyületek felhasználható termékekké redukálására és más üzemanyag-gázokkal kombinálva használják. A karbidokat, a szén- és fémvegyületeket számos ipari folyamatban használják, gyakran más fémszerkezetek stabilizálására; kalcium-karbidot használnak például ipari kémiai vegyületek előállítására. A szén-diszulfid és a szén-tetraklorid erőteljes oldószerek ((bár a rákkeltő anyagként való besorolása óta a CCl4 használata csökkent). A cianid a halogenidionokhoz hasonlóan viselkedik, sót és savat egyaránt képezve. A hidrogén-cianid (HCN) gyenge sav, rendkívül alacsony forrásponttal (valójában szobahőmérsékleten), és műanyaggyártásban használják.A cianid dimert cianogénnek nevezik, és szerves szintézisekben, füstölőkben és rakéta-hajtóanyagokban használják.