Grupa 14: Ogólne właściwości i reakcje
Węgiel
Węgiel jest czwartym najliczniej występującym pierwiastkiem na Ziemi. Jest szczególnie interesujący w chemii organicznej, ponieważ jest wyróżnikiem związku organicznego. Jest również uważany za „kręgosłup” biologii, ponieważ wszystkie formy życia na Ziemi są oparte na węglu. Wynika to z dwóch ważnych cech węgla: jego niewielkich rozmiarów i unikalnej konfiguracji elektronowej. Ponieważ atomy węgla są małe, ich elektrony p-orbitalne w znacznym stopniu zachodzą na siebie i umożliwiają tworzenie wiązań π. Porównaj struktury molekularne CO2 i SiO2 poniżej:
Konfiguracja elektronowa węgla pozwala na tworzenie bardzo stabilnych wiązań z tlen i wodór. Wiązania te magazynują olbrzymią ilość energii. Tworzenie (utrwalanie) i rozrywanie (spalanie) tych wiązań w obiegu węgla ułatwia ziemskie życie:
- Wiązanie węgla: w procesie fotosyntezy, rośliny wykorzystują energię słoneczną i cząsteczki chlorofilu, aby zamienić gazowy dwutlenek węgla z atmosfery w proste węglowodany, takie jak glukoza:
\
- Spalanie węgla: podczas oddychania tlenowego rośliny i zwierzęta rozkładają węglowodany na dwutlenek węgla i wodę (jak pokazano na poniższym równaniu) i wykorzystują uwolnioną energię do napędzania działań biologicznych – wzrostu , ruch itp. Ponadto spalanie węglowodanów znajdujących się w paliwach kopalnych zapewnia energię potrzebną do prowadzenia współczesnych czynności.
\
Węgiel jest obok siarki pierwiastkiem o największej zawartości alotropów. Węgiel ma trzy główne alotropy w stanie stałym: grafit, diament i fulereny (z których najbardziej znany, buckminsterfullerene, jest również znany jako „buckyball”). Te alotropy różnią się znacznie strukturą, ale są szeroko stosowane w nowoczesnej produkcji.
Grafit i diament
Grafit ma właściwości smarne, które sprawiają, że doskonale nadaje się do stosowania w ołówkach. Ponieważ składa się z płaszczyzn sześcioczłonowych pierścieni, które łatwo przesuwają się jedna po drugiej, grafit łatwo się ślizga i dlatego jest używany w połączeniu z gliną do tworzenia ołówkowego „ołówka”. Grafit jest również stosowany w postaci włóknistej do różnych tworzyw sztucznych.
Węgiel ma bardzo wysokie temperatury topnienia i wrzenia. Grafit jest najbardziej stabilnym termodynamicznie alotropem węgla w normalnych warunkach. W diamencie, bardziej stabilnym alotropie przy ekstremalnych ciśnieniach (105 atm i więcej), każdy atom węgla jest związany z czterema innymi w układzie tetraedrycznym, w wyniku czego powstaje najtwardsza ze znanych naturalnie występujących substancji. Ta twardość w połączeniu z dobrą zdolnością do rozpraszania ciepła sprawia, że diament i folia diamentowa są doskonałymi materiałami w wiertłach i innych częściach maszyn; jednak najwyższej jakości diamenty naturalne są używane głównie do biżuterii, podczas gdy diamenty niższej jakości, a nawet diamenty syntetyczne są używane do celów przemysłowych.
Fulereny (nazwane na cześć R. Buckminstera Fullera) i nanorurki to seria alotropów węgla, w których pierścienie węglowe tworzą bardziej złożone formy, w tym cząsteczki podobne do piłki nożnej (C60) i rurki przypominające cylindry wykonane z drutu z kurczaka. Podstawą tych alotropów jest grafen, pojedynczy arkusz węglowy o intrygujących właściwościach elektronicznych. Fulereny pojawiają się, gdy pewien procent sześciokątnych pierścieni jest montowanych w pięciokątne pierścienie, co powoduje, że arkusz wykrzywia się w mniej więcej kulisty „Buckyball”. Nanorurka węglowa to po prostu grafen zgięty w cylinder. Niektóre z tych alotropów powstają w wyniku rozkładu grafitu. Spalanie może również dawać alternatywne formy węgla. Ogrzewany węgiel bez powietrza tworzy koks. Podobnie rozgrzane drewno staje się węglem drzewnym, gdy bardziej lotne całki są wypychane.

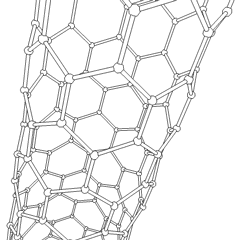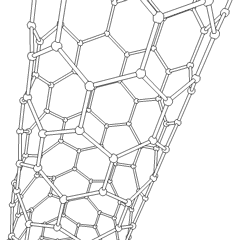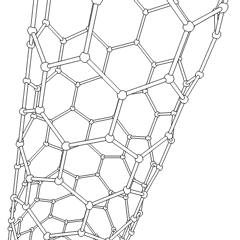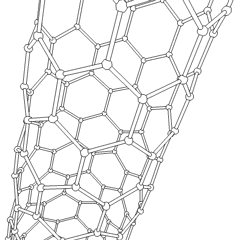
Jest prawie niezliczone ilości różnych związków węgla, ale kilka związków nieorganicznych jest szczególnie ważnych. Tlenek węgla (CO) służy do syntezy innych związków węgla, redukcji związków metali do produktów użytkowych oraz w połączeniu z innymi gazami jako paliwo. Węgliki, związki węgla i metali, są używane w wielu procesach przemysłowych, często do stabilizacji innych konstrukcji metalowych; węglik wapnia jest używany na przykład do wytwarzania przemysłowych związków chemicznych. Dwusiarczek węgla i tetrachlorek węgla są silnymi rozpuszczalnikami (chociaż od czasu jego klasyfikacji jako rakotwórczy, użycie CCl4 spadło). Cyjanek zachowuje się podobnie do jonów halogenkowych, tworząc zarówno sól, jak i kwas. Kwas cyjanowodorowy (HCN) jest słabym kwasem o wyjątkowo niskiej temperaturze wrzenia (w rzeczywistości temperatura pokojowa) i jest stosowany do produkcji tworzyw sztucznych.Dimer cyjankowy nazywany jest cyjanem i jest stosowany w syntezach organicznych, fumigancie i paliwie rakietowym.