Skupina 14: Obecné vlastnosti a reakce
Uhlík
Uhlík je čtvrtým nejhojnějším prvkem na Zemi. Je zvláště zajímavý v organické chemii, protože je charakteristickým znakem organické sloučeniny. Je také považována za „páteř“ biologie, protože všechny formy života na Zemi jsou založeny na uhlíku. To je způsobeno dvěma důležitými vlastnostmi uhlíku: jeho malou velikostí a jedinečnou elektronovou konfigurací. Protože atomy uhlíku jsou malé, jejich p-orbitální elektrony se značně překrývají a umožňují vznik π vazeb. Porovnejte níže uvedené molekulární struktury CO2 a SiO2:
Uhlíková elektronová konfigurace umožňuje vytvářet velmi stabilní vazby s kyslík a vodík. Tyto vazby ukládají obrovské množství energie. Tvorba (fixace) a rozbití (spalování) těchto vazeb v uhlíkovém cyklu usnadňují pozemský život:
- Fixace uhlíku: ve fotosyntéze, rostliny využívají energii ze slunce a molekuly chlorofylu k přeměně plynného oxidu uhličitého z atmosféry na jednoduché sacharidy, jako je glukóza:
\
- Spalování uhlíku: Při aerobním dýchání rostliny a zvířata štěpí sacharidy na oxid uhličitý a vodu (jak je znázorněno v rovnici níže) a uvolněnou energii využívají k podpoře biologických aktivit – růstu , pohyb atd. Kromě toho spalování sacharidů nacházejících se ve fosilních palivech poskytuje energii potřebnou pro moderní činnosti.
\
Vedle síry je uhlík prvkem s největším počtem alotropů. Uhlík má tři hlavní allotropy v pevném stavu: grafit, diamant a fullereny (z nichž nejběžněji známý, buckminsterfullerene, je také známý jako „buckyball“). Tyto allotropes se velmi liší ve struktuře, ale jsou široce používány v moderní výrobě.
Grafit a diamant
Grafit má mazací vlastnosti, díky nimž je velmi vhodný pro použití v tužkách. Protože je tvořen rovinami šestičlenných prstenců, které mohou snadno klouzat kolem sebe, grafit snadno klouže a je proto používán v kombinaci s hlínou k vytvoření tužkového „olova“. Grafit se také používá ve vláknité formě pro různé plasty.
Uhlík má velmi vysoké teploty tání a teploty varu. Grafit je za normálních podmínek termodynamicky nejstabilnější aloskop uhlíku. V diamantu, který je stabilnějším alotropem při extrémních tlacích (105 atm a více), je každý atom uhlíku vázán ke čtyřem dalším v čtyřbokém uspořádání, což má za následek vznik nejtvrdší přirozeně se vyskytující látky. Tato tvrdost v kombinaci s dobrou schopností odvádět teplo činí z diamantu a diamantového filmu vynikající materiály ve vrtácích a jiných částech stroje; nejkvalitnější přírodní diamanty se však používají hlavně pro šperky, zatímco pro průmyslové účely se používá diamant nižší kvality nebo dokonce syntetický diamant.
Fullereny (pojmenované podle R. Buckminstera Fullera) a nanotrubičky jsou série uhlíkových allotropů, ve kterých uhlíkové kruhy tvoří složitější formy, včetně molekul podobných fotbalovému míčku (C60) a trubek připomínajících válce vyrobené z kuřecího drátu. Grafen, jeden uhlíkový list se zajímavými elektronickými vlastnostmi, je základem pro tyto alotropy. Fullereny se vyskytují, když se určité procento šestihranných prstenců spojí do pětiúhelníkových prstenců, což způsobí, že se list zkroutí do zhruba sférického „Buckyball“. Uhlíková nanotrubice je jednoduše grafen ohnutý do válce. Některé z těchto alotropů vznikají při rozkladu grafitu. Spalováním se mohou také získat alternativní uhlíkové formy. Vytápěné uhlí bez vzduchu vytváří koks. Podobně vyhřívané dřevo se stává dřevěným uhlím, protože jsou vytlačovány těkavější částice.

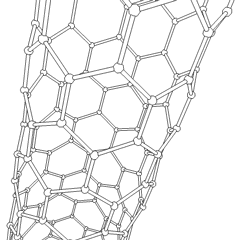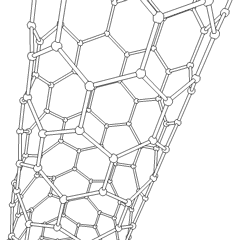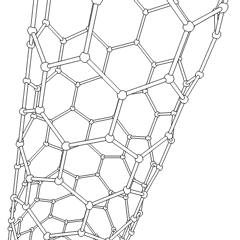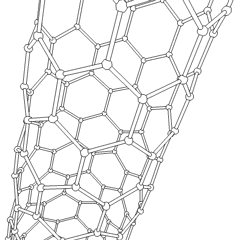
Existuje téměř nespočetné množství různých sloučenin uhlíku, ale zvláště důležitých je několik anorganických sloučenin. Oxid uhelnatý (CO) se používá k syntéze dalších sloučenin uhlíku, redukci sloučenin kovů na použitelné produkty a v kombinaci s jinými plyny na palivo. Karbidy, sloučeniny uhlíku a kovů, se používají v mnoha průmyslových procesech, často ke stabilizaci jiných kovových struktur; karbid vápníku se používá například k výrobě průmyslových chemických sloučenin. Sulfid uhličitý a tetrachlormethan jsou silná rozpouštědla (i když od jeho klasifikace jako karcinogenu použití CCI4 pokleslo). Kyanid se chová podobně jako halogenidové ionty a vytváří sůl i kyselinu. Kyselina kyanovodíková (HCN) je slabá kyselina s extrémně nízkou teplotou varu (ve skutečnosti teplota místnosti) a používá se při výrobě plastů.Kyanidový dimer se nazývá kyanogen a používá se v organických syntézách, fumigantech a raketových pohonných hmotách.