Grupul 14: Proprietăți și reacții generale
Carbon
Carbonul este al patrulea element din abundență pe pământ. Este de un interes deosebit în chimia organică, deoarece este caracteristica distinctivă a unui compus organic. De asemenea, este considerată „coloana vertebrală” a biologiei, întrucât toate formele de viață de pe pământ sunt bazate pe carbon. Acest lucru se datorează a două calități importante ale carbonului: dimensiunea sa mică și configurația sa unică de electroni. Deoarece atomii de carbon sunt mici, electronii lor orbitali p se suprapun considerabil și permit formarea legăturilor π. Comparați structurile moleculare ale CO2 și SiO2 de mai jos:
Configurația electronică a carbonului îi permite să formeze legături foarte stabile cu oxigen și hidrogen. Aceste legături stochează o cantitate enormă de energie. Formarea (fixarea) și ruperea (arderea) acestor legături în ciclul carbonului facilitează viața pământească:
- Fixarea carbonului: în fotosinteză, plantele folosesc energia din soare și moleculele de clorofilă pentru a transforma dioxidul de carbon gazos din atmosferă în carbohidrați simpli precum glucoza:
\
- Arderea carbonului: în respirația aerobă, plantele și animalele descompun carbohidrații în dioxid de carbon și apă (așa cum se arată în ecuația de mai jos) și folosesc energia eliberată pentru a alimenta activitățile biologice – creșterea , mișcare etc. În plus, arderea glucidelor găsite în combustibilii fosili asigură energia necesară activităților moderne.
\
Lângă sulf, carbonul este elementul cu cele mai multe alotropi. Carbonul are trei alotropi principali în stare solidă: grafit, diamant și fulereni (dintre care cel mai frecvent cunoscut, buckminsterfullerene, este, de asemenea, cunoscut sub numele de „buckyball”). Aceste alotropi diferă foarte mult prin structură, dar sunt utilizate pe scară largă în producția modernă.
Grafit și un diamant
Grafitul are proprietăți lubrifiante care îl fac extrem de potrivit pentru utilizarea în creioane. Deoarece este alcătuit din planuri de inele cu șase membri care pot aluneca ușor unul lângă altul, grafitul alunecă ușor și, prin urmare, este utilizat în combinație cu lut pentru a forma creionul „plumb”. Grafitul este, de asemenea, utilizat într-o formă fibroasă pentru diferite materiale plastice.
Carbonul are puncte de topire și fierbere foarte ridicate. Grafitul este cel mai stabil alotrop termodinamic al carbonului în condiții obișnuite. În diamant, alotropul mai stabil la presiuni extreme (105 atm și mai mult), fiecare atom de carbon este legat de alți patru într-un aranjament tetraedric, rezultând cea mai dură substanță naturală cunoscută. Această duritate, combinată cu o bună capacitate de a disipa căldura, face ca diamantul și filmul de diamant să fie materiale excelente în burghie și alte piese ale mașinii; cu toate acestea, diamantele naturale de cea mai bună calitate sunt utilizate în principal pentru bijuterii, în timp ce diamantele de calitate inferioară sau chiar diamantele sintetice sunt utilizate în scopuri industriale.
Fullerenele (numite după R. Buckminster Fuller) și nanotuburile sunt o serie de alotropi de carbon în care inelele de carbon formează forme mai complexe, inclusiv molecule asemănătoare mingii de fotbal (C60) și tuburi asemănătoare cilindrilor din sârmă de pui. Grafenul, o singură foaie de carbon cu proprietăți electronice interesante, stă la baza acestor alotropi. Fulerenele apar atunci când un anumit procent de inele hexagonale sunt asamblate pentru a forma inele pentagonale, determinând foaia să se contorsioneze într-un „Buckyball” aproximativ sferic. Un nanotub de carbon este pur și simplu grafen îndoit într-un cilindru. Unele dintre aceste alotropi se formează în descompunerea grafitului. Arderea poate produce, de asemenea, forme alternative de carbon. Cărbunele încălzit fără aer formează cocs. Lemnul încălzit în mod similar devine cărbune pe măsură ce integranții mai volatili sunt forțați.

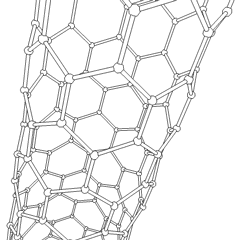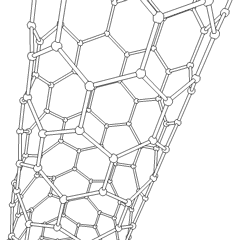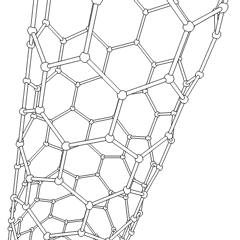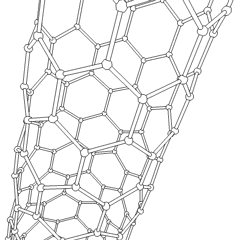
Există o cantitate aproape nenumărată de compuși de carbon diferiți, dar mai mulți compuși anorganici sunt deosebit de importanți. Monoxidul de carbon (CO) este utilizat pentru sintetizarea altor compuși de carbon, reducerea compușilor metalici la produse utilizabile și în combinație cu alte gaze pentru combustibil. Carburii, compuși ai carbonului și metalelor, sunt folosiți în multe procese industriale, adesea pentru a stabiliza alte structuri metalice; carbura de calciu este utilizată pentru fabricarea compușilor chimici industriali, de exemplu. Disulfura de carbon și tetraclorura de carbon sunt solvenți puternici (deși de la clasificarea sa ca cancerigen, utilizarea CCl4 a scăzut). Cianura se comportă similar cu ionii de halogenură, formând atât o sare cât și un acid. Acidul cianhidric (HCN) este un acid slab cu un punct de fierbere extrem de scăzut (temperatura camerei, de fapt) și este utilizat în producția de plastic.Un dimer de cianură se numește cianogen și este utilizat în sinteze organice, fumiganți și propulsor pentru rachete.