Grupo 14: Propiedades y reacciones generales
Carbono
El carbono es el cuarto elemento más abundante en la tierra. Es de particular interés en química orgánica, ya que es la característica distintiva de un compuesto orgánico. También se considera la «columna vertebral» de la biología, ya que todas las formas de vida en la tierra están basadas en carbono. Esto se debe a dos cualidades importantes del carbono: su pequeño tamaño y su configuración electrónica única. Debido a que los átomos de carbono son pequeños, sus electrones orbitales p se superponen considerablemente y permiten que se formen enlaces π. Compare las estructuras moleculares de CO2 y SiO2 a continuación:
La configuración electrónica del carbono le permite formar enlaces muy estables con oxígeno e hidrógeno. Estos enlaces almacenan una enorme cantidad de energía. La formación (fijación) y rotura (combustión) de estos enlaces en el ciclo del carbono facilitan la vida terrestre:
- Fijación de carbono: en la fotosíntesis, las plantas utilizan la energía del sol y las moléculas de clorofila para convertir el dióxido de carbono gaseoso de la atmósfera en carbohidratos simples como la glucosa:
\
- Combustión de carbono: en la respiración aeróbica, las plantas y los animales descomponen los carbohidratos en dióxido de carbono y agua (como se muestra en la siguiente ecuación) y usan la energía liberada para impulsar las actividades biológicas: crecimiento , movimiento, etc. Además, la combustión de los carbohidratos que se encuentran en los combustibles fósiles proporciona la energía necesaria para las actividades modernas.
\
Junto al azufre, el carbono es el elemento con más alótropos. El carbono tiene tres alótropos de estado sólido principales: grafito, diamante y fullerenos (el más conocido de los cuales, el buckminsterfullereno, también se conoce como «buckyball»). Estos alótropos difieren mucho en estructura, pero se utilizan ampliamente en la producción moderna.
Grafito y diamante
El grafito tiene propiedades lubricantes que lo hacen extremadamente adecuado para su uso en lápices. Debido a que está formado por planos de anillos de seis miembros que pueden deslizarse fácilmente entre sí, el grafito se desliza fácilmente y, por lo tanto, se usa en combinación con arcilla para formar una «mina» de lápiz. El grafito también se usa en forma fibrosa para varios plásticos.
El carbono tiene puntos de fusión y ebullición muy altos. El grafito es el alótropo de carbono más estable termodinámicamente en condiciones normales. En el diamante, el alótropo más estable a presiones extremas (105 atm y más), cada átomo de carbono está unido a otros cuatro en una disposición tetraédrica, lo que da como resultado la sustancia natural más dura conocida. Esta dureza, combinada con una buena capacidad para disipar el calor, hace que el diamante y la película de diamante sean materiales excelentes en brocas y otras piezas de máquinas; sin embargo, los diamantes naturales de la más alta calidad se utilizan principalmente para joyería, mientras que los diamantes de menor calidad o incluso el diamante sintético se utilizan con fines industriales.
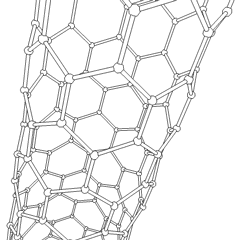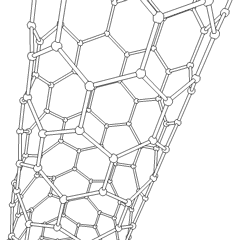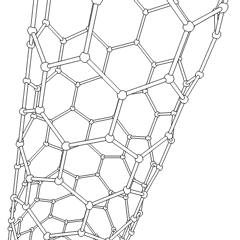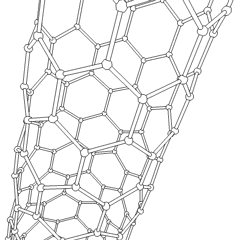
Los fullerenos (llamados así por R. Buckminster Fuller) y los nanotubos son una serie de alótropos de carbono en los que los anillos de carbono forman formas más complejas, incluidas moléculas parecidas a bolas de fútbol (C60) y tubos que se asemejan a cilindros hechos de alambre de gallinero. El grafeno, una única hoja de carbón con interesantes propiedades electrónicas, es la base de estos alótropos. Los fullerenos ocurren cuando un cierto porcentaje de anillos hexagonales se ensamblan para formar anillos pentagonales, lo que hace que la hoja se contorsione en una «bola de Bucky» aproximadamente esférica. Un nanotubo de carbono es simplemente grafeno doblado en un cilindro. Algunos de estos alótropos se forman en la descomposición del grafito. La combustión también puede producir formas de carbono alternativas. El carbón calentado sin aire forma coque. De manera similar, la madera calentada se convierte en carbón vegetal a medida que se alejan más integrandos volátiles.

Hay una cantidad casi innumerable de diferentes compuestos de carbono, pero varios compuestos inorgánicos son particularmente importantes. El monóxido de carbono (CO) se utiliza para sintetizar otros compuestos de carbono, reducir compuestos metálicos a productos utilizables y en combinación con otros gases para combustible. Los carburos, compuestos de carbono y metales, se utilizan en muchos procesos industriales, a menudo para estabilizar otras estructuras metálicas; El carburo de calcio se utiliza para fabricar compuestos químicos industriales, por ejemplo. El disulfuro de carbono y el tetracloruro de carbono son solventes poderosos (aunque desde su clasificación como carcinógeno, el uso de CCl4 ha disminuido). El cianuro se comporta de manera similar a los iones de haluro, formando tanto una sal como un ácido. El ácido cianhídrico (HCN) es un ácido débil con un punto de ebullición extremadamente bajo (de hecho, a temperatura ambiente) y se utiliza en la producción de plástico.Un dímero de cianuro se llama cianógeno y se utiliza en síntesis orgánicas, fumigantes y propulsores de cohetes.