Gruppe 14: Generelle egenskaper og reaksjoner
Karbon
Karbon er det fjerde mest utbredte elementet på jorden. Det er av spesiell interesse for organisk kjemi, da det er kjennetegnet ved en organisk forbindelse. Det regnes også som «ryggraden» i biologien, ettersom alle livsformer på jorden er karbonbaserte. Dette skyldes to viktige karbonkvaliteter: den lille størrelsen og den unike elektronkonfigurasjonen. Fordi karbonatomer er små, overlapper deres p-orbitale elektroner betydelig og gjør det mulig å danne π-bindinger. Sammenlign molekylære strukturer av CO2 og SiO2 nedenfor:
Carbon «s elektronkonfigurasjon av gjør det mulig å danne svært stabile bindinger med oksygen og hydrogen. Disse bindingene lagrer en enorm mengde energi. Dannelsen (fiksering) og brudd (forbrenning) av disse bindingene i karbonsyklusen letter jordelivet:
- Karbonfiksering: I fotosyntese, planter bruker energi fra sol og klorofyllmolekyler for å gjøre gassformig karbondioksid fra atmosfæren til enkle karbohydrater som glukose:
\
- Forbrenning av karbon: I aerob respirasjon bryter planter og dyr karbohydrater ned i karbondioksid og vann (som vist i ligningen nedenfor) og bruker energien som frigjøres for å drive biologiske aktiviteter – vekst , bevegelse osv. I tillegg gir forbrenningen av karbohydrater som finnes i fossile brensler energi som trengs for moderne aktiviteter.
\
Ved siden av svovel er karbon det elementet som har flest allotroper. Karbon har tre viktigste solid state allotroper: grafitt, diamant og fullerener (den mest kjente av dem, buckminsterfullerene, er også kjent som en «buckyball»). Disse allotropene er veldig forskjellige i struktur, men brukes mye i moderne produksjon.
Grafitt og en diamant
Grafitt har smøreegenskaper som gjør den ekstremt velegnet til bruk i blyanter. Fordi den består av plan med seksleddede ringer som lett kan gli forbi hverandre, glir grafitt lett og blir derfor brukt i kombinasjon med leire for å danne bly «bly». Grafitt brukes også i fiberform til forskjellige plastmaterialer.
Karbon har svært høye smelte- og kokepunkter. Grafitt er den mest termodynamisk stabile allotropen av karbon under vanlige forhold. I diamant, den mer stabile allotropen ved ekstreme trykk (105 atm og oppover), er hvert karbonatom bundet til fire andre i et tetraederarrangement, noe som resulterer i det vanskeligste naturlig forekommende stoffet som er kjent. Denne hardheten, kombinert med god evne til å spre varme, gjør diamant- og diamantfilm til utmerkede materialer i bor og andre maskindeler; imidlertid brukes naturlige diamanter av høyeste kvalitet hovedsakelig til smykker, mens diamanter av lavere kvalitet eller til og med syntetisk diamant brukes til industrielle formål.
Fullerenes (oppkalt etter R. Buckminster Fuller) og nanorør er en serie. av karbonallotroper der karbonringer danner mer komplekse former, inkludert fotballballlignende molekyler (C60) og rør som ligner sylindere laget av kyllingetråd. Grafen, et enkelt karbonark med spennende elektroniske egenskaper, er grunnlaget for disse allotropene. Fullerener oppstår når en viss prosentandel av sekskantede ringer er satt sammen for å danne femkantede ringer, noe som får arket til å bøye seg til en omtrent sfærisk «Buckyball». Et karbon-nanorør er ganske enkelt grafen bøyd inn i en sylinder. Noen av disse allotropene dannes ved spaltning av grafitt. Forbrenning kan også gi alternative karbonformer. Oppvarmet kull uten luft danner koks. Tilsvarende oppvarmet tre blir kull ettersom mer flyktige integrander blir tvunget bort.

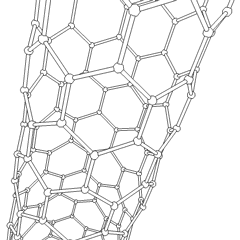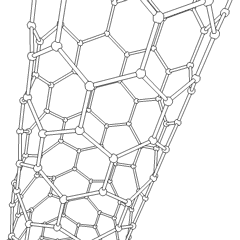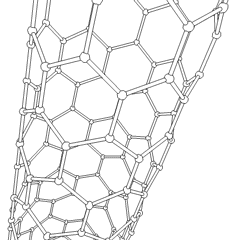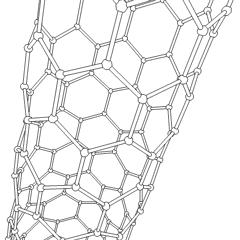
Det er en nesten utallig mengde forskjellige karbonforbindelser, men flere uorganiske forbindelser er spesielt viktige. Karbonmonoksid (CO) brukes til å syntetisere andre karbonforbindelser, redusere metallforbindelser til brukbare produkter, og i kombinasjon med andre gasser for drivstoff. Karbider, forbindelser av karbon og metaller, brukes i mange industrielle prosesser, ofte for å stabilisere andre metallstrukturer; kalsiumkarbid brukes for eksempel til å fremstille industrielle kjemiske forbindelser. Karbondisulfid og karbontetraklorid er kraftige løsemidler, (selv om bruken av CCl4 har gått ned siden klassifiseringen som kreftfremkallende. Cyanid oppfører seg på samme måte som halogenider og danner både et salt og en syre. Hydrocyanic acid (HCN) er en svak syre med et ekstremt lavt kokepunkt (faktisk romtemperatur), og brukes i plastproduksjon.En cyanid-dimer kalles et cyanogen, og den brukes i organiske synteser, fumiganter og rakettdrivmiddel.