グループ14:一般的な特性と反応
炭素
炭素は地球上で4番目に豊富な元素です。それは有機化合物の際立った特徴であるため、有機化学において特に興味深いものです。地球上のすべての生命体は炭素ベースであるため、生物学の「バックボーン」とも見なされます。これは、炭素の2つの重要な性質によるものです。サイズが小さいことと電子配置が独特です。炭素原子は小さいため、それらのp軌道電子はかなり重なり、π結合を形成することができます。以下のCO2とSiO2の分子構造を比較してください。
の炭素の電子配置により、非常に安定した結合を形成できます。酸素と水素。これらの結合は膨大な量のエネルギーを蓄えます。炭素サイクルにおけるこれらの結合の形成(固定)と破壊(燃焼)は、地球の生命を促進します:
- 炭素固定:光合成では、植物は太陽からのエネルギーとクロロフィル分子を使用して、大気中のガス状二酸化炭素をグルコースなどの単純な炭水化物に変換します。
\
- 炭素の燃焼:好気性呼吸では、植物や動物が炭水化物を二酸化炭素と水に分解し(下の式を参照)、放出されたエネルギーを使用して生物学的活動、つまり成長を促進します。 、動きなど。さらに、化石燃料に含まれる炭素の燃焼は、現代の活動に必要なエネルギーを提供します。
\
硫黄の次に、炭素は最も同素体を持つ元素です。炭素には、グラファイト、ダイアモンド、フラーレンの3つの主要な固体同素体があります(最も一般的に知られているバックミンスターフラーレンは、「バッキーボール」としても知られています)。これらの同素体は構造が大きく異なりますが、現代の生産で広く使用されています。
グラファイトとダイヤモンド
グラファイトには潤滑性があり、鉛筆での使用に非常に適しています。グラファイトは、互いに滑りやすい6員環の平面で構成されているため、滑りやすく、粘土と組み合わせて鉛筆の「鉛」を形成します。グラファイトは、さまざまなプラスチックに繊維状で使用されています。
炭素は非常に高い融点と沸点を持っています。グラファイトは、通常の条件下で最も熱力学的に安定した炭素の同素体です。ダイヤモンドでは、極端な圧力(105 atm以上)でより安定した同素体であり、各炭素原子は四面体配列で他の4つの原子と結合し、既知の最も硬い天然物質をもたらします。この硬度は、熱を放散する優れた能力と相まって、ダイヤモンドとダイヤモンドフィルムをドリルビットやその他の機械部品の優れた材料にします。ただし、最高品質の天然ダイヤモンドは主にジュエリーに使用されますが、低品質のダイヤモンドや合成ダイヤモンドでさえ工業用に使用されます。
フラーレン(R.バックミンスターフラーにちなんで名付けられました)とナノチューブはシリーズですサッカーボールのような分子(C60)やチキンワイヤーで作られたシリンダーに似たチューブなど、炭素環がより複雑な形を形成する炭素同素体の例。興味深い電子特性を備えた単一のカーボンシートであるグラフェンは、これらの同素体の基礎です。フラーレンは、一定の割合の六角形のリングが組み立てられて五角形のリングを形成し、シートがほぼ球形の「バッキーボール」にねじれるときに発生します。カーボンナノチューブは、単にグラフェンを円筒状に曲げたものです。これらの同素体のいくつかは、グラファイトの分解で形成されます。燃焼により、別の炭素形態が生じることもあります。空気のない加熱された石炭はコークスを形成します。同様に、加熱された木材は、揮発性の被積分体が追い出されると木炭になります。

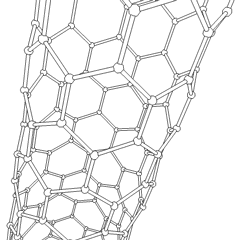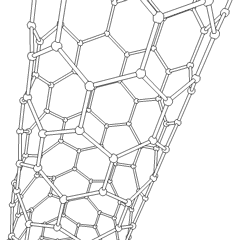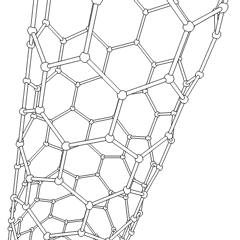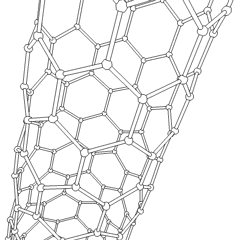
ありますほぼ無数の異なる炭素化合物ですが、いくつかの無機化合物が特に重要です。一酸化炭素(CO)は、他の炭素化合物の合成、金属化合物の使用可能な製品への還元、および燃料用の他のガスとの組み合わせに使用されます。炭素と金属の化合物である炭化物は、他の金属構造を安定させるために、多くの工業プロセスで使用されます。炭化カルシウムは、例えば、工業用化合物の製造に使用されます。二硫化炭素と四塩化炭素は強力な溶媒です(発がん性物質として分類されて以来、CCl4の使用は減少しています)。シアン化物はハロゲン化物イオンと同様に動作し、塩と酸の両方を形成します。青酸(HCN)は、沸点(実際には室温)が非常に低い弱酸であり、プラスチックの製造に使用されます。シアン化物二量体はシアン化物と呼ばれ、有機合成、燻蒸剤、ロケット推進剤に使用されます。