Groupe 14: Propriétés générales et réactions
Carbone
Le carbone est le quatrième élément le plus abondant sur terre. Il présente un intérêt particulier en chimie organique, car cest la caractéristique distinctive dun composé organique. Il est également considéré comme la «colonne vertébrale» de la biologie, car toutes les formes de vie sur terre sont à base de carbone. Cela est dû à deux qualités importantes du carbone: sa petite taille et sa configuration électronique unique. Parce que les atomes de carbone sont petits, leurs électrons orbitaux p se chevauchent considérablement et permettent la formation de liaisons π. Comparez les structures moléculaires du CO2 et du SiO2 ci-dessous:
La configuration électronique du carbone lui permet de former des liaisons très stables avec oxygène et hydrogène. Ces liaisons stockent une énorme quantité d’énergie. La formation (fixation) et la rupture (combustion) de ces liaisons dans le cycle du carbone facilitent la vie terrestre:
- Fixation du carbone: dans la photosynthèse, les plantes utilisent lénergie du soleil et des molécules de chlorophylle pour transformer le dioxyde de carbone gazeux de latmosphère en glucides simples comme le glucose:
\
- Combustion du carbone: dans la respiration aérobie, les plantes et les animaux décomposent les glucides en dioxyde de carbone et en eau (comme indiqué dans léquation ci-dessous) et utilisent lénergie libérée pour alimenter les activités biologiques – croissance , mouvement, etc. De plus, la combustion des glucides contenus dans les combustibles fossiles fournit lénergie nécessaire aux activités modernes.
\
Après le soufre, le carbone est lélément avec le plus dallotropes. Le carbone a trois principaux allotropes à létat solide: le graphite, le diamant et les fullerènes (dont le plus connu, le buckminsterfullerène, est également appelé «buckyball»). Ces allotropes diffèrent grandement dans leur structure mais sont largement utilisés dans la production moderne.
Graphite et un diamant
Le graphite possède des propriétés lubrifiantes qui le rendent parfaitement adapté à une utilisation dans les crayons. Parce quil est composé danneaux à six membres qui peuvent facilement glisser les uns sur les autres, le graphite glisse facilement et est donc utilisé en combinaison avec de largile pour former un crayon « plomb ». Le graphite est également utilisé sous forme fibreuse pour divers plastiques.
Le carbone a des points de fusion et débullition très élevés. Le graphite est lallotrope de carbone le plus stable thermodynamiquement dans des conditions ordinaires. Dans le diamant, lallotrope le plus stable aux pressions extrêmes (105 atm et plus), chaque atome de carbone est lié à quatre autres dans un arrangement tétraédrique, ce qui donne la substance naturelle la plus dure connue. Cette dureté, combinée à une bonne capacité à dissiper la chaleur, fait du diamant et du film de diamant dexcellents matériaux dans les forets et autres pièces de machine; cependant, les diamants naturels de la plus haute qualité sont principalement utilisés pour les bijoux, tandis que les diamants de qualité inférieure ou même les diamants synthétiques sont utilisés à des fins industrielles.
Les fullerènes (du nom de R. Buckminster Fuller) et les nanotubes sont une série dallotropes de carbone dans lesquels les anneaux de carbone forment des formes plus complexes, y compris des molécules de type ballon de football (C60) et des tubes ressemblant à des cylindres en grillage. Le graphène, une seule feuille de carbone aux propriétés électroniques intrigantes, est à la base de ces allotropes. Les fullerènes se produisent lorsquun certain pourcentage danneaux hexagonaux sont assemblés pour former des anneaux pentagonaux, provoquant la déformation de la feuille en un «Buckyball» à peu près sphérique. Un nanotube de carbone est simplement du graphène plié dans un cylindre. Certains de ces allotropes se forment lors de la décomposition du graphite. La combustion peut également produire des formes de carbone alternatives. Le charbon chauffé sans air forme du coke. De même, le bois chauffé devient du charbon de bois à mesure que des intégrands plus volatils sont chassés.

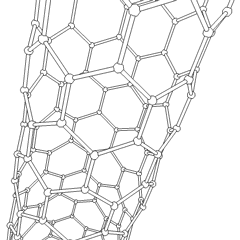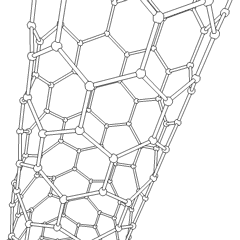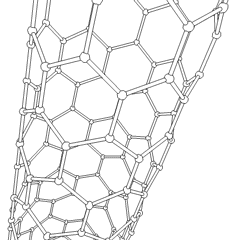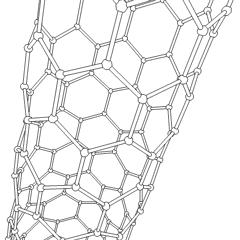
Il y a une quantité presque innombrable de différents composés carbonés, mais plusieurs composés inorganiques sont particulièrement importants. Le monoxyde de carbone (CO) est utilisé pour synthétiser dautres composés de carbone, réduire les composés métalliques en produits utilisables et en combinaison avec dautres gaz pour le carburant. Les carbures, composés de carbone et de métaux, sont utilisés dans de nombreux procédés industriels, souvent pour stabiliser dautres structures métalliques; le carbure de calcium est utilisé pour fabriquer des composés chimiques industriels, par exemple. Le disulfure de carbone et le tétrachlorure de carbone sont de puissants solvants (bien que depuis sa classification comme cancérigène, lutilisation de CCl4 ait diminué). Le cyanure se comporte de la même manière que les ions halogénure, formant à la fois un sel et un acide. Lacide cyanhydrique (HCN) est un acide faible avec un point débullition extrêmement bas (température ambiante en fait), et est utilisé dans la production de plastique.Un dimère de cyanure est appelé un cyanogène, et il est utilisé dans les synthèses organiques, les fumigants et le propulseur de fusée.