Grupp 14: Allmänna egenskaper och reaktioner
Kol
Kol är det fjärde vanligaste elementet på jorden. Det är av särskilt intresse för organisk kemi, eftersom det är det kännetecknande för en organisk förening. Det anses också vara ”ryggraden” i biologin, eftersom alla livsformer på jorden är kolbaserade. Detta beror på två viktiga egenskaper hos kol: dess lilla storlek och dess unika elektronkonfiguration. Eftersom kolatomer är små överlappar deras p-orbitalelektroner avsevärt och gör att π-bindningar kan bildas. Jämför de molekylära strukturerna för CO2 och SiO2 nedan:
Kolets elektronkonfiguration av gör det möjligt att bilda mycket stabila bindningar med syre och väte. Dessa bindningar lagrar en enorm mängd energi. Bildningen (fixering) och brott (förbränning) av dessa bindningar i kolcykeln underlättar jordliv:
- Kolfixering: I fotosyntes, växter använder energi från solen och klorofyllmolekyler för att förvandla gasformig koldioxid från atmosfären till enkla kolhydrater som glukos:
\
- Kolförbränning: I aerob andning bryter växter och djur ned kolhydrater i koldioxid och vatten (som visas i ekvationen nedan) och använder den energi som frigörs för att bränna biologiska aktiviteter – tillväxt , rörelse etc. Dessutom ger förbränningen av kolhydrater som finns i fossila bränslen energi som behövs för moderna aktiviteter.
\
Bredvid svavel är kol det element som har flest allotroper. Kol har tre huvudsakliga fasta tillståndsallotroper: grafit, diamant och fullerener (den mest kända av dessa, buckminsterfulleren, är också känd som en ”buckyball”). Dessa allotroper skiljer sig mycket åt i struktur men används ofta i modern produktion.
Grafit och en diamant
Grafit har smörjegenskaper som gör den extremt lämplig för användning i pennor. Eftersom den består av plan med sexledade ringar som lätt kan glida förbi varandra, glider grafit lätt och används därför i kombination med lera för att bilda bly ”bly”. Grafit används också i fiberform för olika plaster.
Kol har mycket höga smält- och kokpunkter. Grafit är den mest termodynamiskt stabila allotropen av kol under vanliga förhållanden. I diamant, den mer stabila allotropen vid extrema tryck (105 atm och uppåt), är varje kolatom bunden till fyra andra i ett tetraedriskt arrangemang, vilket resulterar i den hårdaste naturligt förekommande substansen som är känd. Denna hårdhet i kombination med god förmåga att sprida värme gör diamant- och diamantfilm till utmärkta material i borrkronor och andra maskindelar; emellertid används högkvalitativa naturliga diamanter främst för smycken, medan diamanter av lägre kvalitet eller till och med syntetisk diamant används för industriella ändamål.
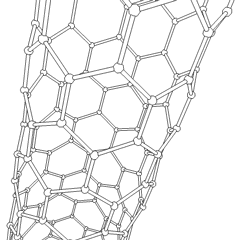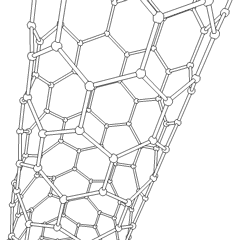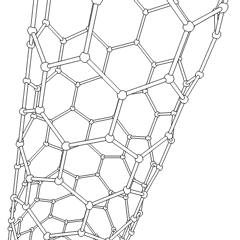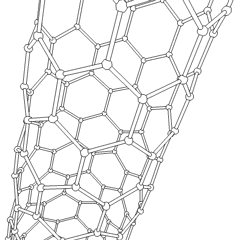
Fullerenes (uppkallad efter R. Buckminster Fuller) och nanorör är en serie av kolallotroper där kolringar bildar mer komplexa former, inklusive fotbollsliknande molekyler (C60) och rör som liknar cylindrar gjorda av kycklingtråd. Grafen, ett enda kolark med spännande elektroniska egenskaper, är grunden för dessa allotroper. Fullerener uppstår när en viss procentsats av sexkantiga ringar är sammansatta för att bilda femkantiga ringar, vilket får arket att förvrängas till en ungefär sfärisk ”Buckyball”. Ett kolnanorör är helt enkelt grafen böjt i en cylinder. Några av dessa allotroper bildas vid sönderdelning av grafit. Förbränning kan också ge alternativa kolformer. Uppvärmt kol utan luft bildar koks. På samma sätt blir uppvärmt trä träkol när mer flyktiga integranter tvingas bort.

Det finns en nästan otalig mängd olika kolföreningar, men flera oorganiska föreningar är särskilt viktiga. Kolmonoxid (CO) används för att syntetisera andra kolföreningar, reducera metallföreningar till användbara produkter och i kombination med andra gaser för bränsle. Karbider, föreningar av kol och metaller, används i många industriella processer, ofta för att stabilisera andra metallstrukturer; kalciumkarbid används till exempel för att tillverka industriella kemiska föreningar. Koldisulfid och koltetraklorid är kraftfulla lösningsmedel (även om användningen av CCl4 har minskat sedan dess klassificering som cancerframkallande). Cyanid beter sig på samma sätt som halidjoner och bildar både ett salt och en syra. Hydrocyanic acid (HCN) är en svag syra med en extremt låg kokpunkt (faktiskt rumstemperatur) och används vid plastproduktion.En cyaniddimer kallas cyanogen och används i organiska synteser, rökmedel och raketdrivmedel.