Grupo 14: Propriedades Gerais e Reações
Carbono
O carbono é o quarto elemento mais abundante na Terra. É de particular interesse em química orgânica, pois é a característica distintiva de um composto orgânico. Também é considerada a “espinha dorsal” da biologia, já que todas as formas de vida na Terra são baseadas em carbono. Isso se deve a duas qualidades importantes do carbono: seu tamanho pequeno e sua configuração eletrônica única. Como os átomos de carbono são pequenos, seus elétrons orbitais p se sobrepõem consideravelmente e permitem a formação de ligações π. Compare as estruturas moleculares de CO2 e SiO2 abaixo:
A configuração eletrônica do carbono permite que ele forme ligações muito estáveis com oxigênio e hidrogênio. Essas ligações armazenam uma enorme quantidade de energia. A formação (fixação) e a quebra (combustão) dessas ligações no ciclo do carbono facilitam a vida terrena:
- Fixação de carbono: na fotossíntese, as plantas usam energia do sol e moléculas de clorofila para transformar dióxido de carbono gasoso da atmosfera em carboidratos simples como a glicose:
\
- Combustão de carbono: na respiração aeróbica, plantas e animais quebram carboidratos em dióxido de carbono e água (como mostrado na equação abaixo) e usam a energia liberada para alimentar atividades biológicas – crescimento , movimento, etc. Além disso, a combustão de carboidratos encontrados em combustíveis fósseis fornece a energia necessária para atividades modernas.
\
Depois do enxofre, o carbono é o elemento com mais alótropos. O carbono tem três alótropos principais no estado sólido: grafite, diamante e fulerenos (o mais comumente conhecido dos quais, buckminsterfullereno, também é conhecido como “buckyball”). Esses alótropos diferem muito na estrutura, mas são amplamente usados na produção moderna.
Grafite e um diamante
O grafite tem propriedades lubrificantes que o tornam extremamente adequado para uso em lápis. Por ser feito de planos de anéis de seis membros que podem deslizar facilmente uns sobre os outros, o grafite desliza facilmente e, portanto, é usado em combinação com argila para formar “grafite” do lápis. O grafite também é usado em uma forma fibrosa para vários plásticos.
O carbono tem pontos de fusão e ebulição muito altos. A grafite é o alótropo de carbono mais termodinamicamente estável em condições normais. No diamante, o alótropo mais estável em pressões extremas (105 atm e acima), cada átomo de carbono está ligado a quatro outros em um arranjo tetraédrico, resultando na substância de ocorrência natural mais dura conhecida. Essa dureza, combinada com uma boa capacidade de dissipar calor, torna o diamante e o filme de diamante excelentes materiais em brocas e outras peças de máquinas; no entanto, os diamantes naturais de mais alta qualidade são usados principalmente para joias, enquanto o diamante de baixo grau ou mesmo o diamante sintético é usado para fins industriais.
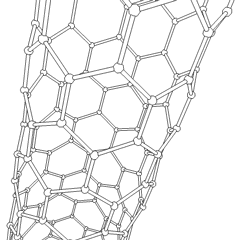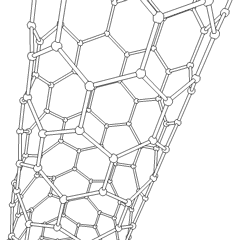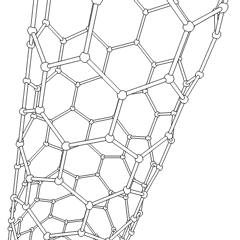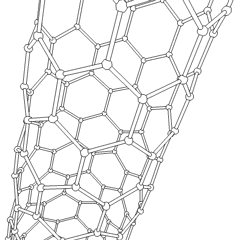
Fulerenos (em homenagem a R. Buckminster Fuller) e nanotubos são uma série de alótropos de carbono em que os anéis de carbono formam formas mais complexas, incluindo moléculas semelhantes a bolas de futebol (C60) e tubos semelhantes a cilindros feitos de tela de arame. O grafeno, uma única folha de carbono com propriedades eletrônicas intrigantes, é a base para esses alótropos. Os fulerenos ocorrem quando uma certa porcentagem de anéis hexagonais são reunidos para formar anéis pentagonais, fazendo com que a folha se contorne em um “Buckyball” aproximadamente esférico. Um nanotubo de carbono é simplesmente grafeno dobrado em um cilindro. Alguns desses alótropos são formados na decomposição da grafite. A combustão também pode produzir formas alternativas de carbono. O carvão aquecido sem ar forma coque. Da mesma forma, a madeira aquecida torna-se carvão à medida que integrantes mais voláteis são forçados a desaparecer.

Existe uma quantidade quase inumerável de diferentes compostos de carbono, mas vários compostos inorgânicos são particularmente importantes. O monóxido de carbono (CO) é usado para sintetizar outros compostos de carbono, reduzindo os compostos de metal a produtos utilizáveis e em combinação com outros gases para combustível. Carbonetos, compostos de carbono e metais, são usados em muitos processos industriais, muitas vezes para estabilizar outras estruturas metálicas; o carboneto de cálcio é usado para fabricar compostos químicos industriais, por exemplo. O dissulfeto de carbono e o tetracloreto de carbono são solventes poderosos (embora desde sua classificação como cancerígeno, o uso de CCl4 tenha diminuído). O cianeto se comporta de maneira semelhante aos íons haleto, formando um sal e um ácido. O ácido cianídrico (HCN) é um ácido fraco com ponto de ebulição extremamente baixo (na verdade, temperatura ambiente) e é usado na produção de plásticos.Um dímero de cianeto é chamado de cianogênio e é usado em sínteses orgânicas, fumigantes e propelente de foguete.