Groep 14: Algemene eigenschappen en reacties
Koolstof
Koolstof is het vierde meest voorkomende element op aarde. Het is van bijzonder belang in de organische chemie, omdat het het onderscheidende kenmerk is van een organische verbinding. Het wordt ook beschouwd als de “ruggengraat” van de biologie, aangezien alle levensvormen op aarde op koolstof zijn gebaseerd. Dit komt door twee belangrijke eigenschappen van koolstof: zijn kleine formaat en zijn unieke elektronenconfiguratie. Omdat koolstofatomen klein zijn, overlappen hun p-orbitale elektronen elkaar aanzienlijk en maken π-bindingen mogelijk. Vergelijk de moleculaire structuren van CO2 en SiO2 hieronder:
Door de elektronenconfiguratie van koolstof kan het zeer stabiele bindingen vormen met zuurstof en waterstof. Deze bindingen slaan een enorme hoeveelheid energie op. De vorming (fixatie) en breuk (verbranding) van deze bindingen in de koolstofcyclus vergemakkelijken het aardse leven:
- Koolstoffixatie: bij fotosynthese, planten gebruiken energie van de zon en chlorofylmoleculen om gasvormig kooldioxide uit de atmosfeer om te zetten in eenvoudige koolhydraten zoals glucose:
\
- Koolstofverbranding: bij aërobe ademhaling breken planten en dieren koolhydraten af in kooldioxide en water (zoals weergegeven in de onderstaande vergelijking) en gebruiken ze de energie die vrijkomt om biologische activiteiten te stimuleren: groei , beweging, enz. Bovendien levert de verbranding van koolhydraten uit fossiele brandstoffen de energie die nodig is voor moderne activiteiten.
\
Naast zwavel is koolstof het element met de meeste allotropen. Koolstof heeft drie belangrijke allotropen in vaste toestand: grafiet, diamant en fullerenen (waarvan de meest bekende, buckminsterfullereen, ook bekend staat als een “buckyball”). Deze allotropen verschillen enorm in structuur, maar worden veel gebruikt in moderne productie.
Grafiet en een diamant
Grafiet heeft smerende eigenschappen waardoor het uitermate geschikt is voor gebruik in potloden. Omdat het bestaat uit vlakken van zesringen die gemakkelijk langs elkaar kunnen glijden, glijdt grafiet gemakkelijk en wordt het daarom in combinatie met klei gebruikt om potlood “lood” te vormen. Grafiet wordt ook in vezelvorm gebruikt voor verschillende kunststoffen.
Koolstof heeft zeer hoge smelt- en kookpunten. Grafiet is de thermodynamisch meest stabiele allotroop van koolstof onder normale omstandigheden. In diamant, de stabielere allotrope bij extreme drukken (105 atm en hoger), is elk koolstofatoom aan vier andere gebonden in een tetraëdrische opstelling, wat resulteert in de hardste natuurlijk voorkomende stof die we kennen. Deze hardheid, gecombineerd met een goed vermogen om warmte af te voeren, maakt van diamant en diamantfilm uitstekende materialen voor boren en andere machineonderdelen; natuurlijke diamanten van de hoogste kwaliteit worden echter voornamelijk gebruikt voor sieraden, terwijl diamant van lagere kwaliteit of zelfs synthetische diamant wordt gebruikt voor industriële doeleinden.
Fullerenen (genoemd naar R. Buckminster Fuller) en nanobuisjes zijn een serie van koolstofallotropen waarin koolstofringen complexere vormen vormen, waaronder voetbalbalachtige moleculen (C60) en buizen die lijken op cilinders gemaakt van kippengaas. Grafeen, een enkele carbonplaat met intrigerende elektronische eigenschappen, vormt de basis voor deze allotropen. Fullerenen komen voor wanneer een bepaald percentage zeshoekige ringen wordt geassembleerd om vijfhoekige ringen te vormen, waardoor het vel in een ongeveer bolvormige “Buckyball” verdraait. Een koolstofnanobuisje is gewoon grafeen dat in een cilinder is gebogen. Sommige van deze allotropen worden gevormd bij de ontbinding van grafiet. Verbranding kan ook alternatieve koolstofvormen opleveren. Verwarmde kolen zonder lucht vormen cokes. Op dezelfde manier wordt verwarmd hout houtskool naarmate meer vluchtige integranden worden verdreven.

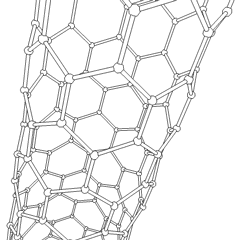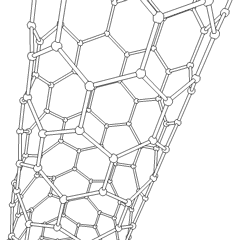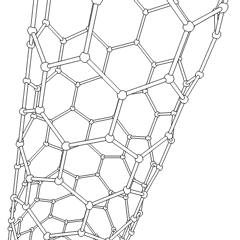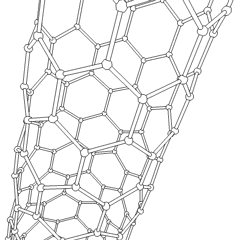
Er is een bijna ontelbare hoeveelheid verschillende koolstofverbindingen, maar verschillende anorganische verbindingen zijn bijzonder belangrijk. Koolmonoxide (CO) wordt gebruikt voor het synthetiseren van andere koolstofverbindingen, het reduceren van metaalverbindingen tot bruikbare producten en in combinatie met andere gassen als brandstof. Carbiden, verbindingen van koolstof en metalen, worden in veel industriële processen gebruikt, vaak om andere metaalstructuren te stabiliseren; calciumcarbide wordt bijvoorbeeld gebruikt om industriële chemische verbindingen te maken. Koolstofdisulfide en koolstoftetrachloride zijn krachtige oplosmiddelen (hoewel het gebruik van CCl4 sinds de classificatie als kankerverwekkend is afgenomen). Cyanide gedraagt zich op dezelfde manier als halogenide-ionen en vormt zowel een zout als een zuur. Blauwzuur (HCN) is een zwak zuur met een extreem laag kookpunt (in feite kamertemperatuur) en wordt gebruikt bij de productie van kunststof.Een cyanide-dimeer wordt een cyanogeen genoemd en wordt gebruikt in organische syntheses, ontsmettingsmiddelen en raketbrandstof.