9.9 En introduktion til organisk syntese
Mål
Når du er færdig med dette afsnit, skal du være i stand til at designe en flertrinssyntese at forberede et givet produkt ud fra et givet udgangsmateriale ved hjælp af en af reaktionerne introduceret i lærebogen op til dette punkt.
Studienoter
Du skal har bemærket, at nogle af de tildelte problemer har krævet, at du strenger sammen et antal organiske reaktioner for at konvertere en organisk forbindelse til en anden, når der ikke er nogen enkelt reaktion for at nå dette mål. En sådan række reaktioner kaldes en “organisk syntese.” Et af de vigtigste mål for dette kursus er at hjælpe dig med at designe sådanne synteser. For at nå dette mål skal du have alle de reaktioner, der er beskrevet i kurset, tilgængelige i din hukommelse. Du bliver nødt til at huske nogle reaktioner meget oftere end andre, og den eneste måde at mestre dette mål på er at øve. Eksemplerne i dette kapitel vil være relativt enkle, men du vil snart se, at du kan udtænke nogle ret sofistikerede synteser ved hjælp af et begrænset antal grundlæggende reaktioner.
Undersøgelsen af organisk kemi udsætter en studerende for en bred vifte af indbyrdes relaterede reaktioner. Alkener kan for eksempel omdannes til strukturelt ens alkaner, alkoholer, alkylhalogenider, epoxider, glycoler og boraner; spaltet til mindre aldehyder, ketoner og carboxylsyrer og forstørret ved carbocation og radikale tilsætninger samt cycloadditions. Alle disse produkter kan efterfølgende omdannes til et væld af nye forbindelser, der indeholder en bred variation forskellige funktionelle grupper og derved åben for endnu mere uddybning. Derfor bliver den logiske opfattelse af en flertrinssyntese til konstruktionen af en udpeget forbindelse fra et specificeret udgangsmateriale et af de mest udfordrende problemer, der kan stilles.
En et eller to-trins sekvens af enkle reaktioner er ikke så svært at udlede. Hvis man for eksempel bliver bedt om at forberede meso-3,4-hexandiol fra 3-hexyne, er de fleste studerende klar over, at det vil være nødvendigt at reducere alkynen til cis eller trans-3-hexen, før de foretager glykoldannelse. Permanaganat eller osmiumtetroxidhydroxylering af cis-3-hexen ville danne den ønskede meso-isomer. Fra trans-3-hexen ville det være nødvendigt først at epoxidere alkenen med en persyre, efterfulgt af ringåbning med hydroxidion. Dette eksempel illustrerer et fælles træk ved syntese: ofte er der mere end en effektiv procedure, der fører til det ønskede produkt.
Længere flertrinssynteser kræver omhyggelig analyse og overvejelse, da mange muligheder skal overvejes. Ligesom en ekspert skakspiller, der evaluerer fordele og ulemper ved potentielle bevægelser på lang rækkevidde, skal kemikeren vurdere den potentielle succes for forskellige mulige reaktionsveje med fokus på omfanget og begrænsningerne, der begrænser hver af de individuelle reaktioner, der anvendes. Dette kan være en afskrækkende opgave, hvis færdighed erhverves af erfaring og ofte forsøg og fejl.
De tre eksempler vist nedenfor er illustrative. Den første er et simpelt funktionelt gruppekonverteringsproblem, der oprindeligt kan virke vanskeligt. Det er ofte nyttigt at arbejde baglæns fra disse. I dette tilfælde skal det være tydeligt, at cyclohexanol kan erstatte cyclohexanon, da sidstnævnte derefter kunne fremstilles ved en simpel oxidation. Da cyclohexan (og alkaner generelt) er relativt ureaktiv, synes bromering (eller klorering) også at være et indlysende første trin. På dette tidspunkt fristes man til at omdanne bromocyclohexan til cyclohexanol ved en SN2-reaktion med hydroxidion. Denne reaktion ville utvivlsomt være ledsaget af E2-eliminering, så det ville være renere, selvom det er et trin længere, at først fremstille cyclohexen og derefter hydrere det ved hjælp af en af flere metoder (fx oxymercuration og hydroboration) inklusive den viste ved at klikke på diagrammet
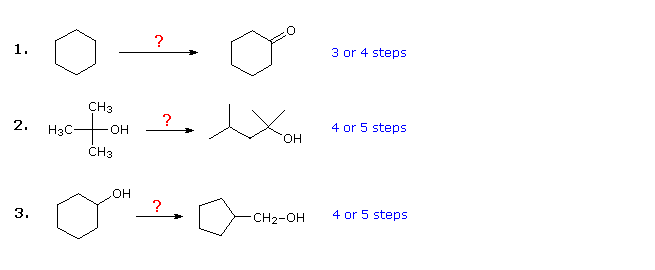 Svar
Svar
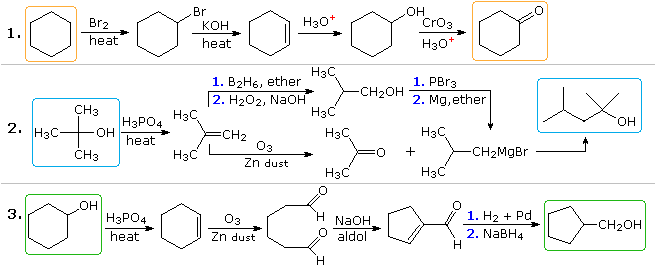
Plausible løsninger til det andet og tredje problem vises også ovenfor på dette tidspunkt. I opgave 2 har det ønskede produkt syv carbonatomer, og udgangsmaterialet har fire. Det er klart, at to mellemprodukter afledt af udgangsforbindelsen skal sammenføjes, og et kulstof skal gå tabt, enten før eller efter denne binding finder sted. 3º-alkoholfunktionen i produktet antyder dannelse af en Grignard-tilsætning til en keton, og isobuten synes at være en god forløber for hver af disse reaktanter, som vist. Reaktanten og produktforbindelserne i det tredje problem er isomerer, men en eller anden form for bindingsbrydende og bindingsdannende sekvens er klart nødvendig for at denne strukturændring skal forekomme. En mulig procedure er vist ovenfor. Syrekatalyseret omlejring af cyclohexenoxid efterfulgt af reduktion kan også tjene.
Den nyttige tilgang til træning af synteser startende fra målmolekylet og bagud mod enklere udgangsmaterialer er blevet formaliseret af prof. E. J. Corey (Harvard) og betegnet retrosyntetisk analyse. I denne procedure transformeres målmolekylet gradvist til enklere strukturer ved at afbryde udvalgte kulstof-kulstofbindinger. Disse afbrydelser hviler på transformationer, som er det modsatte af plausible syntetiske konstruktioner. Hver enklere struktur, således genereret, bliver udgangspunktet for yderligere frakoblinger, hvilket fører til et forgrenet sæt af indbyrdes forbundne mellemprodukter. En retrosyntetisk transformation er afbildet med symbolet = >, som vist nedenfor for tidligere eksempler 2 & 3. Når en komplet analyse er udført kan den ønskede syntese udføres ved anvendelse af reaktionerne bag transformationerne.
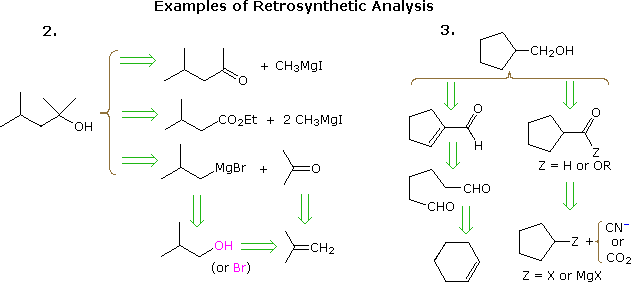
Ovenstående diagram tilvejebringer ikke et komplet sæt transformationer til dette mål forbindelser. Når et startmateriale er specificeret, som i ovenstående problemer, skal de foreslåede veje afspejle denne begrænsning. Således passer 4-methyl-2-pentanon- og 3-methylbutyratestermulighederne i eksempel 2, selv om de er helt rimelige, ikke godt sammen med en tert-butanol-start. Ligeledes kan et cyclopentylmellemprodukt tilvejebringe en fremragende vej til produktet i eksempel 3, men ikke opfylder de specificerede betingelser for problemet.
Retrosyntetisk analyse er især nyttig, når man overvejer relativt komplekse molekyler uden udgangsmaterialebegrænsninger. Hvis det gennemføres uden bias, vises der nogle gange usædvanlige og spændende muligheder. Desværre fører molekylær kompleksitet (sammensat af størrelse, funktionalitet, inkorporering af heteroatom, cyklisk forbindelse og stereoisomerisme) generelt til meget store og omfattende forgrenede transformationstræer. Computerassisteret analyse har vist sig nyttig, men i sidste ende spiller kemikerens instinkter og erfaring en afgørende rolle for at nå frem til en vellykket syntetisk plan. Nogle relativt enkle eksempler, hvoraf de fleste har udgangsmaterialebegrænsninger, findes nedenfor.
Øvelser
Spørgsmål
Q9.9.1
Start ved 3-hexyne forudsiger syntetiske ruter for at opnå:
A – cis-3-hexen
B – 3,4-dibromhexan
C – 3-hexanol
Q9.9.2
Startende med acetylen og eventuelle alkylhalogenider foreslår en syntese til fremstilling af (a) pentanal og (b) hexan.
Løsninger
S9.9.1

S9.9.2
.png?revision=1)
Bidragydere og tilskrivninger
-
Dr. Dietmar Kennepohl FCIC (professor i kemi, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, professor emeritus (Michigan State U.), virtuel lærebog om organisk kemi