12.2: Molforhold
Molforhold
Støkiometri-problemer kan karakteriseres ved to ting: (1) den information, der gives i problemet, og (2) de oplysninger, der skal løses for, kaldet det ukendte. Det givne og det ukendte kan begge være reaktanter, begge være produkter, eller den ene kan være en reaktant, mens den anden er et produkt. Mængderne af stofferne kan udtrykkes i mol. I en laboratoriesituation er det imidlertid almindeligt at bestemme mængden af et stof ved at finde dets masse i gram. Mængden af et gasformigt stof kan udtrykkes ved dets volumen. I dette koncept vil vi fokusere på typen af problem, hvor både de givne og de ukendte størrelser udtrykkes i mol.

Kemiske ligninger udtrykker mængderne af reaktanter og produkter i en reaktanter og produkter i en reaktion. Koefficienterne for en afbalanceret ligning kan repræsentere enten antallet af molekyler eller antallet af mol af hvert stof. Produktionen af ammoniak \ (\ venstre (\ ce {NH_3} \ højre) \) fra nitrogen- og brintgasser er en vigtig industriel reaktion kaldet Haber-processen efter tysk kemiker Fritz Haber.
\
Den afbalancerede ligning kan analyseres på flere måder som vist i nedenstående figur.
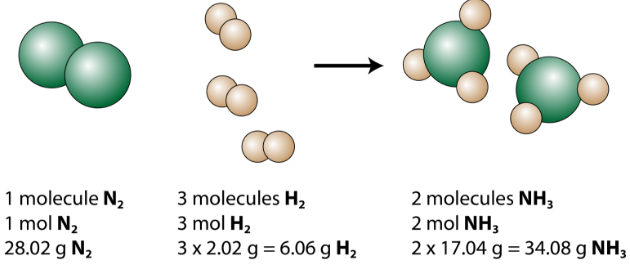
Vi ser, at 1 nitrogenmolekyle reagerer med 3 molekyler hydrogen og danner 2 ammoniakmolekyler. Dette er den mindst mulige relative mængde af reaktanterne og produkterne. For at overveje større relative beløb kan hver koefficient ganges med det samme antal. For eksempel vil 10 nitrogenmolekyler reagere med 30 molekyler hydrogen for at producere 20 ammoniakmolekyler.
Den mest nyttige mængde til at tælle partikler er molen. Så hvis hver koefficient multipliceres med et mol, fortæller den afbalancerede kemiske ligning os, at 1 mol nitrogen reagerer med 3 mol brint til dannelse af 2 mol ammoniak. Dette er den konventionelle måde at fortolke enhver afbalanceret kemisk ligning på.
\
Masse og antallet af atomer skal konserveres i enhver kemisk reaktion. Antallet af molekyler er ikke nødvendigvis bevaret.

Et molforhold er en konverteringsfaktor, der relaterer mængderne i mol af to stoffer i en kemisk reaktion. Tallene i en konverteringsfaktor kommer fra koefficienterne i den afbalancerede kemiske ligning. Følgende seks molforhold kan skrives til den ammoniakdannende reaktion ovenfor.
I et molforholdsproblem skrives det givne stof, udtrykt i mol, først. Den passende konverteringsfaktor vælges for at konvertere fra mol af det givne stof til mol af det ukendte.