12.2: Molforhold (Norsk)
Molforhold
Støkiometriproblemer kan karakteriseres av to ting: (1) informasjonen som gis i problemet, og (2) informasjonen som skal løses for, referert til som det ukjente. Det gitte og det ukjente kan begge være reaktanter, begge være produkter, eller den ene kan være en reaktant mens den andre er et produkt. Mengden av stoffene kan uttrykkes i mol. I laboratoriesituasjoner er det imidlertid vanlig å bestemme mengden av et stoff ved å finne massen i gram. Mengden av et gassformig stoff kan uttrykkes av volumet. I dette konseptet vil vi fokusere på typen problem der både de gitte og de ukjente størrelsene uttrykkes i mol.

Kjemiske ligninger uttrykker mengden av reaktanter og produkter i en reaktanter og produkter i en reaksjon. Koeffisientene til en balansert ligning kan representere enten antall molekyler eller antall mol av hvert stoff. Produksjonen av ammoniakk \ (\ venstre (\ ce {NH_3} \ høyre) \) fra nitrogen- og hydrogengasser er en viktig industriell reaksjon kalt Haber-prosessen, etter tysk kjemiker Fritz Haber.
\
Den balanserte ligningen kan analyseres på flere måter, som vist i figuren nedenfor.
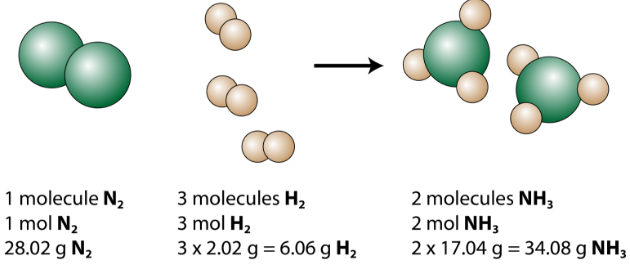
Vi ser at 1 molekyl nitrogen reagerer med 3 molekyler hydrogen og danner 2 ammoniakkmolekyler. Dette er den minste mulige relative mengden av reaktantene og produktene. For å vurdere større relative beløp kan hver koeffisient multipliseres med det samme tallet. For eksempel vil 10 molekyler nitrogen reagere med 30 molekyler hydrogen for å produsere 20 ammoniakkmolekyler.
Den mest nyttige mengden for å telle partikler er mol. Så hvis hver koeffisient multipliseres med et mol, forteller den balanserte kjemiske ligningen at 1 mol nitrogen reagerer med 3 mol hydrogen for å produsere 2 mol ammoniakk. Dette er den konvensjonelle måten å tolke en hvilken som helst balansert kjemisk ligning.
\
Masse og antall atomer må konserveres i enhver kjemisk reaksjon. Antall molekyler er ikke nødvendigvis konservert.

Et molforhold er en konverteringsfaktor som relaterer mengdene i mol av to stoffer i en kjemisk reaksjon. Tallene i en omregningsfaktor kommer fra koeffisientene til den balanserte kjemiske ligningen. Følgende seks molforhold kan skrives for den ammoniakkdannende reaksjonen ovenfor.
I et molforholdsproblem skrives den gitte substansen, uttrykt i mol, først. Den passende konverteringsfaktoren er valgt for å konvertere fra mol av det gitte stoffet til mol av det ukjente.