Le défibrillateur portable Cardioverter: une vie (gilet) de controverse

États-Unis La Food and Drug Administration (FDA) a approuvé en 2001 un dispositif médical après que son essai clinique pivot ait démontré linnocuité et lefficacité chez cinq patients sur sept ayant reçu un traitement.1 Pendant plus dune décennie, des études observationnelles réelles avec le dispositif médical ont décrit des variations interprétations de lutilité.
En 2018, 17 ans après lapprobation de la FDA, les résultats du premier essai contrôlé randomisé du dispositif médical ont révélé des résultats négatifs.2 À ce jour, ce dispositif médical continue dêtre prescrit, et , dans certaines institutions, est devenue la norme de soins. Cest lhistoire du LifeVest®, le seul défibrillateur cardioverter portable (WCD) approuvé par la FDA et indiqué pour réduire le risque de mort cardiaque subite (SCD) chez les patients avec une fraction déjection ventriculaire gauche réduite (LVEF) qui ont souffert dun infarctus aigu du myocarde (AMI).
Le rôle dun DAI dans le contexte post-AMI immédiat chez les patients avec une FEVG ≤ 35-40% a déjà été exploré dans deux essais contrôlés randomisés (DINAMIT et IRIS) .3, 4 Dans DINAMIT, il y avait un taux significativement plus faible de SCD chez les patients randomisés pour ICD que sans ICD (4% vs 8%; p = 0,009), mais il y avait un taux significativement plus élevé de décès non-SCD dans le groupe ICD que dans le groupe sans CIM (15% vs 9%; p = 0,02). De même dans IRIS, il y avait un taux significativement plus faible de SCD chez les patients randomisés pour ICD que sans ICD (6% vs 13%; p = 0,049), mais il y avait un taux significativement plus élevé de décès non-SCD dans le groupe ICD que dans le groupe sans DCI (15% contre 9%; p = 0,001).
Bien que les DCI aient été associés à un risque plus faible de SCD dans ces essais randomisés, cela a été compensé par lassociation avec un risque élevé des événements non-SCD. En conséquence, les lignes directrices actuelles de lACC / AHA / HRS recommandent limplantation dun DCI pour la prévention primaire de la drépanocytose dans cette population après une période de 40 jours de traitement médical dirigé par les lignes directrices (ou une période de 90 jours de traitement médical dirigé par (Figure 1) .5
Figure 1: Prévention primaire de la drépanocytose chez les patients atteints de cardiopathie ischémique
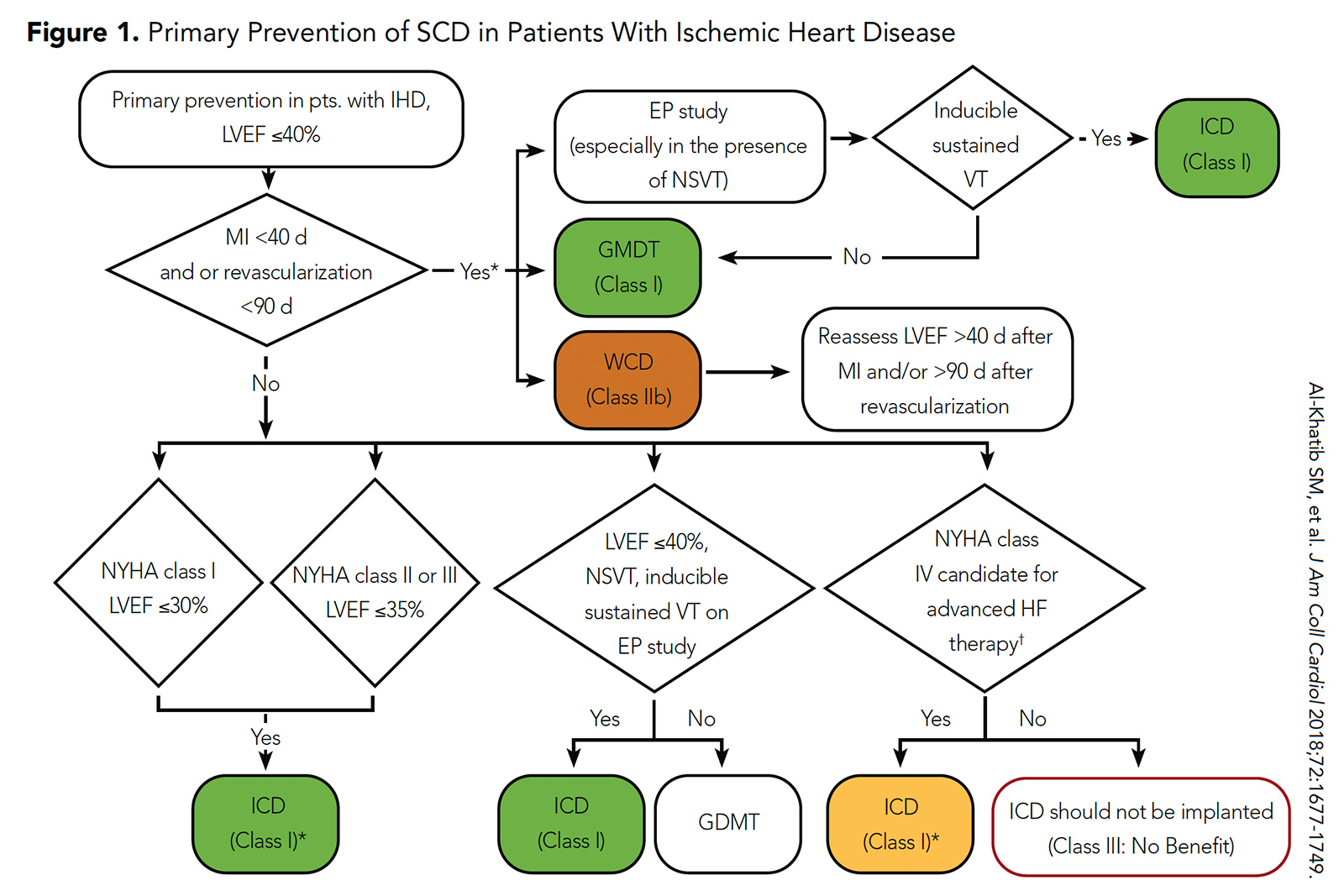 Cliquez sur limage ci-dessus pour lagrandir.
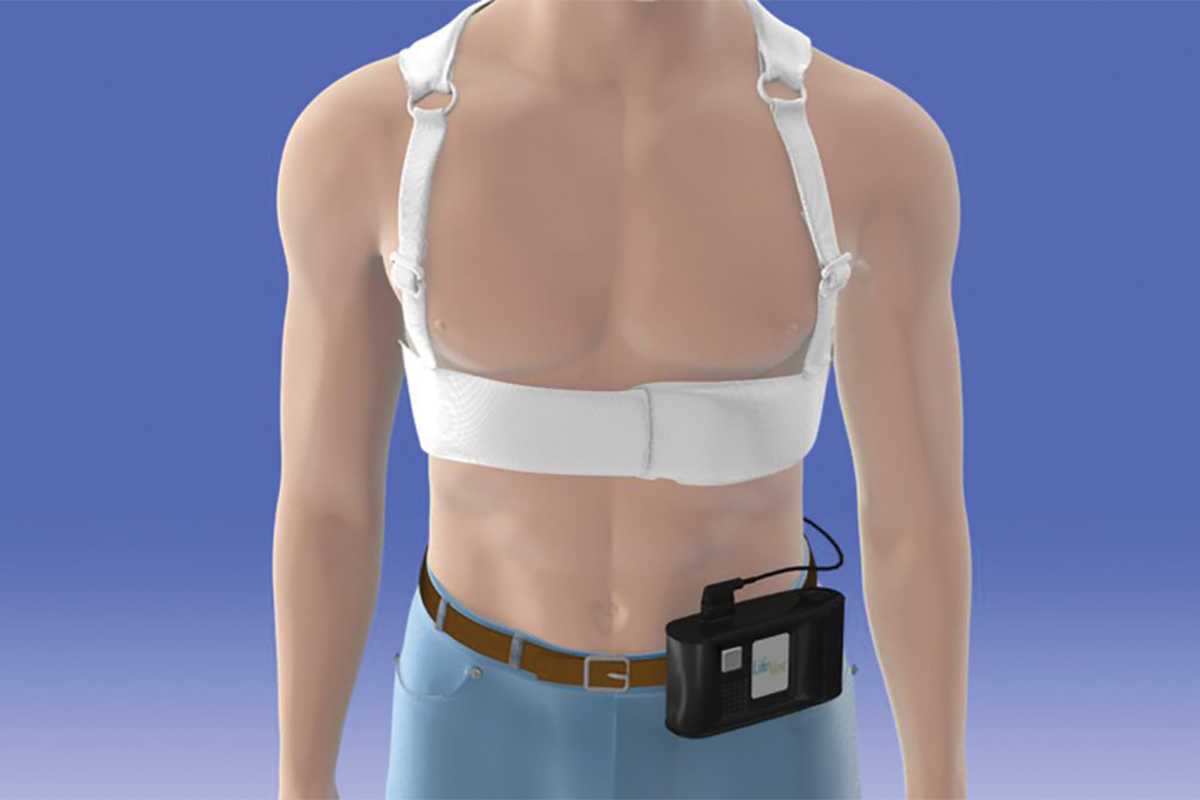
Cliquez sur limage ci-dessus pour lagrandir. Figure 2: Guide 2017 ACC / AHA / HRS pour lutilisation du défibrillateur portable Cardioverter
 Cliquez sur limage ci-dessus pour lagrandir.
Cliquez sur limage ci-dessus pour lagrandir.
Cependant, le risque de SCD dans la période post-AMI immédiate est le plus élevé au cours des 30 premiers jours. Lessai VALIANT a recruté 14 609 patients avec une FEVG ≤ 40% après AMI et a démontré que 7% des patients ont subi une mort subite ou un arrêt cardiaque sur une période de suivi de deux ans. Un nombre alarmant de 19% de ces décès est survenu dans les 30 premiers jours suivant lAMI, et le risque était le plus élevé chez les patients avec une FEVG ≤30% (2,3% par mois) .6
Pris avec les résultats de DINAMIT et IRIS, les résultats de VALIANT ont indiqué la nécessité dune stratégie non-ICD pour protéger les patients contre la survenue de SCD. Le WCD, qui était déjà approuvé par la FDA au moment de ces essais, semblait être la solution parfaite.
La version actuellement disponible du WCD est le LifeVest de Zoll Medical Corporation.7 Lappareil se compose dun vêtement de poitrine avec deux électrodes de défibrillateur positionnées verticalement le long du dos, une ceinture frontale contenant une électrode de défibrillateur positionnée horizontalement avec des électrodes qui détectent le rythme cardiaque et une petite boîte de contrôle qui enregistre les rythmes et contient la batterie. Une fois activé, le LifeVest peut fournir au patient trois alarmes possibles: une alerte gong qui indique quune attention est requise sur le boîtier du moniteur; une alerte de vibration qui indique quune arythmie létale a été détectée et que la séquence de traitement WCD est en cours dactivation; et une alerte de sirène qui indique quun choc est imminent. Immédiatement avant ladministration du choc, un gel bleu est libéré des trois électrodes de défibrillation sur le patient pour améliorer le contact pour la conduction électrique. Le vecteur choquant se trouve entre les électrodes du défibrillateur à larrière et la plaquette du défibrillateur dans la ceinture frontale.
Lexpérience du monde réel avec le WCD a été décrite dans de nombreuses études publiées de 2001 à 2018. Lune des les plus grandes cohortes de patients étudiées comprenaient 8 453 patients du registre Zoll. Au total, 133 patients (1,6%) ont reçu 309 chocs appropriés dont 91% des chocs ont réussi à réanimer le patient dune tachyarythmie ventriculaire (84% chez les patients non revascularisés et 95% chez les patients revascularisés). Le temps médian entre lAMI et le choc était de 16 jours et 75% des chocs se sont produits dans le mois suivant lAMI.8
Létude VEST tant attendue a été présentée comme un essai clinique de dernière minute par lauteur principal Jeffrey E. Olgin, MD, FACC, à ACC.18, et finalement publié dans le New England Journal of Medicine.Le but de lessai VEST était de déterminer lefficacité de la WCD pendant la période avant que les DCI ne soient indiqués chez les patients qui ont eu un infarctus du myocarde et une FEVG réduite. Sur une période de recrutement de près de dix ans, lessai a randomisé 2302 patients atteints dAMI et dune FEVG ≤ 35% dans un rapport de 2: 1 à WCD vs pas de WCD. Lanalyse a été menée en intention de traiter.
Les résultats de VEST étaient notables pour aucune différence significative dans le résultat composite principal de mort subite ou de mort par tachycardie ventriculaire ou fibrillation ventriculaire à 90 jours (arythmie décès), survenue chez 1,6% des patients du groupe WCD et chez 2,4% des patients du groupe sans WCD (risque relatif, 0,66; intervalle de confiance à 95%, 0,37-121; p = 0,18).
Notamment, 43 patients (2,8%) du groupe WCD nont jamais porté dappareil et 20 patients (2,6%) du groupe non WCD ont reçu lappareil en dehors de létude; 10 patients dans le groupe WCD (0,7%) et 15 patients dans le groupe sans WCD (1,5%) ont été perdus de vue, et deux patients dans chaque groupe (5% au total) avaient des données insuffisantes pour déterminer la cause de mort. Les auteurs ont exprimé des inquiétudes sur le fait que le non-respect du port du WCD dans le groupe WCD pourrait avoir réduit la puissance de létude, car le temps de port prévu de 70% des WCD na été atteint que dans les deux premières semaines de lessai. En fin de compte, lessai VEST a été considéré comme une étude négative sur la capacité du WCD à réduire significativement le risque de SCD dans sa population cible.2
Cependant, les résultats négatifs nont pas semblé dissuader lutilisation de WCD et a plutôt encouragé les chercheurs à contester ses conclusions. La plus grande méta-analyse disponible de 28 études portant sur 33242 patients (y compris le bras interventionnel de lessai VEST) de 2001 à 2018 a révélé que des traitements WCD appropriés, des chocs WCD appropriés et des chocs WCD inappropriés se produisaient à un taux de 7/100 personnes , 5/100 personnes et 2/100 personnes, respectivement, sur une période de trois mois.
Dans cette méta-analyse, les patients atteints de cardiomyopathie ischémique, de cardiomyopathie non ischémique et de cardiomyopathie mixte ont présenté une WCD appropriée traitements à raison de 8/100 personnes, 6/100 personnes et 3/100 personnes, respectivement, sur une période de trois mois. Par rapport aux patients atteints de cardiomyopathie ischémique en VEST, les patients atteints de cardiomyopathie ischémique dans la cohorte non-VEST ont démontré une incidence plus élevée de traitement WCD approprié (11/100 personnes vs 1/100 personnes sur trois mois). En examinant le modèle de prescription de WCD, les auteurs ont fait lobservation intéressante que lutilisation continue de WCD « est probablement motivée par le caractère définitif de la SCD et en partie par la peur dun litige, malgré labsence de données à lappui. » 9
La deuxième de ces études a examiné la mortalité et les coûts associés à lutilisation de WCD chez 16 935 patients à partir des données de réclamations de Medicare. Lutilisation de la WCD était associée à une réduction significative de la mortalité à un an après AMI (19,8% vs 11,5%; p = 0,017), et cette réduction de 8,3% de la mortalité absolue correspondait à un rapport coût-efficacité différentiel (ICER) de 12373 $. En dautres termes, lutilisation du WCD coûte 12 373 $ pour sauver une vie la première année après lAMI. Selon la déclaration de lACC / AHA sur la méthodologie coût / valeur dans les directives de pratique clinique et les mesures de performance, lICER pour la WCD serait classée comme une ressource de grande valeur (ICER 12
Bien que le parcours pour lacceptation de la WCD ait détourné, il a gagné sa place parmi la courte liste des dispositifs médicaux modernes qui sauvent des vies. Par conséquent, dans la plus récente directive ACC / AHA / HRS 2017, lutilisation dun WCD après AMI chez les patients avec une FEVG ≤ 35% a a reçu une recommandation IIb (Figure 2) .5
Comme toutes les thérapies, le WCD est plus efficace lorsquil est utilisé tel que prescrit, mais cela nécessite une observance continue pendant jusquà 90 jours ainsi quune attention constante envers les différents des alarmes de lappareil qui peuvent sactiver à tout moment. Des développements sont en cours pour améliorer les vêtements, les moniteurs et lexpérience globale du patient, mais ladhésion limitera probablement la population de patients qui bénéficiera réellement de cet appareil encombrant. En attendant, il restera en place t o au cardiologue de décider quels patients sont les candidats les plus appropriés pour non seulement recevoir le LifeVest, mais aussi le porter.

Cet article a été rédigé par Edward Chu, MD, (@Ed_Chu_MD), boursier en électrophysiologie en formation (FIT) au Mount Sinai Medical Center à New York.
- Feldman AM, Klein H, Tchou P, et al. Enquêteurs et coordinateurs WEARIT; Chercheurs et coordinateurs BIROAD. Utilisation dun défibrillateur portable pour mettre fin aux tachyarythmies chez les patients à haut risque de mort subite: résultats de WEARIT / BIROAD. Pacing Clin Electrophysiol 2004; 27 (1): 4-9.
- Olgin JE, Pletcher MJ, Vittinghoff E, et al. Enquêteurs VEST. Défibrillateur cardioverter portable après un infarctus du myocarde.N Engl J Med 2018; 379: 1205-15.
- Hohnloser SH, Kuck KH, Dorian P, et al; Enquêteurs DINAMIT. Utilisation prophylactique dun défibrillateur cardioverter implantable après un infarctus aigu du myocarde. N Engl J Med 2004; 351: 2481-8.
- Steinbeck G., Andresen D, Seidl K, et al; Investigateurs IRIS. Implantation du défibrillateur tôt après linfarctus du myocarde. N Engl J Med 2009; 361: 1427-36.
- Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. Directive 2017 AHA / ACC / HRS pour la prise en charge des patients souffrant darythmies ventriculaires et la prévention de la mort cardiaque subite: Résumé exécutif: Un rapport de lAmerican College of Cardiology / American Heart Association Task Force on Clinical Practice Guidelines et de la Heart Rhythm Society. J Am Coll Cardiol 2018; 72: 1677-1749.
- Solomon SD, Zelenkofske S, McMurray JJ, et al. Valsartan dans les investigateurs de lessai sur linfarctus aigu du myocarde (VALIANT). Mort subite chez les patients présentant un infarctus du myocarde et une dysfonction ventriculaire gauche, une insuffisance cardiaque ou les deux. N Engl J Med 2005; 352: 2581-8.
- Zoll LifeVest. Zoll Medical Corporation. Disponible ici Consulté le 13 septembre 2020.
- Epstein AE, Abraham WT, Bianco NR, et al. Utilisation dun cardioverter-défibrillateur portable chez les patients perçus comme présentant un risque élevé après un infarctus du myocarde. J Am Coll Cardiol 2013; 62: 2000-7.
- Masri A, Altibi AM, Erqou S, et al. Thérapie cardioverter-défibrillateur portable pour la prévention de la mort cardiaque subite: une revue systématique et une méta-analyse. JACC Clin Electrophysiol 2019; 5: 152-61.
- Olgin JE, Lee BK, Vittinghoff E, et al. Impact de la conformité du cardioverter-défibrillateur portable sur les résultats de lessai VEST: analyses telles que traitées et par protocole. J Cardiovasc Electrophysiol 2020; 31: 1009-18.
- Clark MA, Szymkiewicz SJ, Volosin K. Mortalité et coûts associés aux défibrillateurs cardioverter portables après un infarctus aigu du myocarde: une analyse de cohorte rétrospective des données de réclamations dassurance-maladie. J Innov Card Rhythm Manag 2019; 10: 3866-73.
- Anderson JL, Heidenreich PA, Barnett PG, et al; Groupe de travail ACC / AHA sur les mesures du rendement; Groupe de travail ACC / AHA sur les directives pratiques. Déclaration de lACC / AHA sur la méthodologie coût / valeur dans les directives de pratique clinique et les mesures du rendement: un rapport de lAmerican College of Cardiology / American Heart Association Task Force on Performance Measures et Task Force on Practice Guidelines. J Am Coll Cardiol 2014; 63: 2304-22.
Thèmes cliniques: Arythmies et EP clinique, SCD / arythmies ventriculaires
Mots clés: Publications ACC, Cardiology Magazine, United States Food and Drug Administration, approbation des dispositifs, Fibrillation ventriculaire, Incidence, Volume dAVC, Risque, Intervalles de confiance, Medicare, Coût -Analyse des avantages, vibration, études de suivi, objectifs, analyse de lintention de traiter, perte de suivi, norme de soins
< Retour aux listes