9.9 Une introduction à la synthèse organique
Objectif
Après avoir terminé cette section, vous devriez être en mesure de concevoir une synthèse en plusieurs étapes pour préparer un produit donné à partir dun matériau de départ donné, en utilisant lune des réactions introduites dans le manuel jusquà présent.
Notes détude
Vous devriez ont remarqué que certains des problèmes assignés ont exigé que vous enchaîniez un certain nombre de réactions organiques pour convertir un composé organique en un autre lorsquil ny a pas de réaction unique pour atteindre cet objectif. Une telle série de réactions est appelée «synthèse organique». Lun des objectifs majeurs de ce cours est de vous aider à concevoir de telles synthèses. Pour atteindre cet objectif, vous devrez avoir toutes les réactions décrites dans le cours disponibles dans votre mémoire. Vous devrez vous rappeler certaines réactions beaucoup plus fréquemment que dautres, et la seule façon de maîtriser cet objectif est de sexercer. Les exemples donnés dans ce chapitre seront relativement simples, mais vous verrez bientôt que vous pouvez concevoir des synthèses assez sophistiquées en utilisant un nombre limité de réactions de base.
Létude de la chimie organique expose un étudiant à un large éventail de réactions interdépendantes. Les alcènes, par exemple, peuvent être convertis en alcanes, alcools, halogénures dalkyle, époxydes, glycols et boranes structurellement similaires; clivés en plus petits aldéhydes, cétones et acides carboxyliques; et élargis par carbocation et additions radicalaires ainsi que cycloadditions. Tous ces produits peuvent être transformés ultérieurement en une multitude de nouveaux composés incorporant une large variété de groupes fonctionnels, et donc ouverts à une élaboration encore plus approfondie. Par conséquent, la conception logique dune synthèse en plusieurs étapes pour la construction dun composé désigné à partir dun matériau de départ spécifié devient lun des problèmes les plus difficiles qui puissent être posés.
Une séquence en une ou deux étapes de réactions simples est pas si difficile à déduire. Si, par exemple, on demande de préparer du méso-3,4-hexanediol à partir de la 3-hexyne, la plupart des étudiants se rendent compte quil sera nécessaire de réduire lalcyne en cis ou trans-3-hexène avant dentreprendre la formation du glycol. Lhydroxylation du permanent ou du tétroxyde dosmium du cis-3-hexène formerait lisomère méso souhaité. A partir du trans-3-hexène, il serait nécessaire dépoxyde dabord lalcène avec un peracide, suivi dune ouverture du cycle avec lion hydroxyde. Cet exemple illustre une caractéristique commune en synthèse: il existe souvent plus dune procédure efficace qui mène au produit souhaité.
Les synthèses en plusieurs étapes plus longues nécessitent une analyse et une réflexion minutieuses, car de nombreuses options doivent être envisagées. Comme un joueur déchecs expert évaluant les avantages et les inconvénients à long terme des mouvements potentiels, le chimiste doit évaluer le succès potentiel des divers chemins de réaction possibles, en se concentrant sur la portée et les limites qui contraignent chacune des réactions individuelles utilisées. Cela peut être une tâche ardue, dont la compétence est acquise par lexpérience, et souvent par essais et erreurs.
Les trois exemples ci-dessous sont illustratifs. Le premier est un simple problème de conversion de groupe fonctionnel, qui peut sembler difficile au départ. Il est souvent utile de traiter ces problèmes à lenvers, en commençant par le produit. Dans ce cas, il doit être évident que le cyclohexanol peut se substituer à la cyclohexanone, car celle-ci pourrait alors être réalisée par une simple oxydation. De plus, étant donné que le cyclohexane (et les alcanes en général) est relativement non réactif, la bromation (ou la chloration) semble être une première étape évidente. A ce stade, on est tenté de convertir le bromocyclohexane en cyclohexanol par une réaction SN2 avec lion hydroxyde. Cette réaction saccompagnerait sans aucun doute dune élimination de lE2, il serait donc plus propre, bien quune étape de plus, de faire dabord du cyclohexène puis de lhydrater par lune des méthodes suivantes (par exemple, oxymercuration et hydroboration), y compris celle indiquée en cliquant sur le diagramme
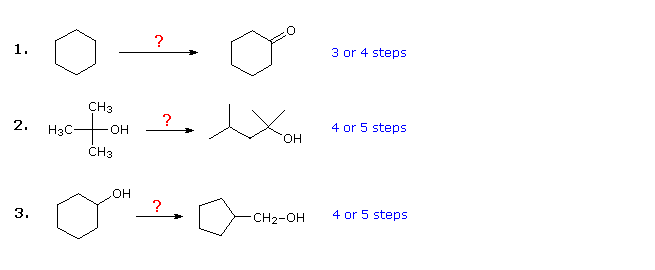 Réponse
Réponse
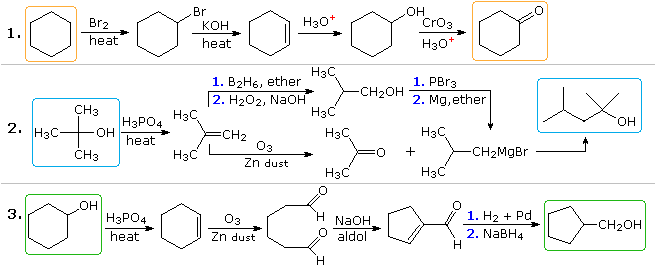
Des solutions plausibles pour le deuxième et le troisième problème apparaîtront également ci-dessus À ce point. Dans le problème 2, le produit souhaité a sept atomes de carbone et la matière de départ en a quatre. Il est clair que deux intermédiaires dérivés du composé de départ doivent être réunis et un carbone doit être perdu, soit avant, soit après cette liaison. La fonction 3º-alcool dans le produit suggère une formation par addition de Grignard à une cétone, et lisobutène semble être un bon précurseur de chacun de ces réactifs, comme indiqué. Les composés réactifs et produits dans le troisième problème sont des isomères, mais une sorte de séquence de rupture de liaison et de création de liaison est clairement nécessaire pour que ce changement structurel se produise. Une procédure possible est illustrée ci-dessus. Un réarrangement de loxyde de cyclohexène catalysé par un acide, suivi dune réduction, pourrait également servir.
Lapproche utile consistant à élaborer des synthèses à partir de la molécule cible et à remonter vers des matériaux de départ plus simples a été formalisée par le professeur E. J. Corey (Harvard) et appelée analyse rétrosynthétique. Dans cette procédure, la molécule cible est progressivement transformée en structures plus simples en déconnectant des liaisons carbone-carbone sélectionnées. Ces déconnexions reposent sur des transformées, qui sont linverse des constructions synthétiques plausibles. Chaque structure plus simple, ainsi générée, devient le point de départ dautres déconnexions, conduisant à un ensemble ramifié dintermédiaires interdépendants. Une transformation rétrosynthétique est représentée par le symbole = >, comme indiqué ci-dessous pour les exemples précédents 2 & 3. Une fois lanalyse complète effectuée , la synthèse souhaitée peut être effectuée par application des réactions sous-jacentes aux transformées.
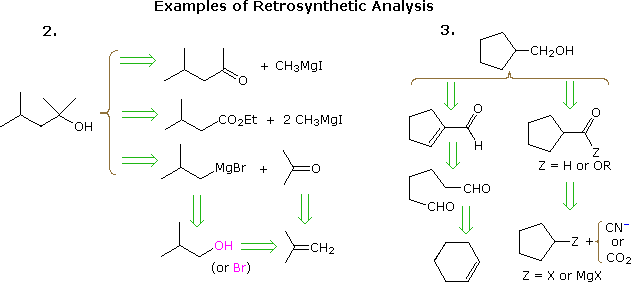
Le diagramme ci-dessus ne fournit pas un ensemble complet de transformées pour ces cibles composés. Lorsquun matériau de départ est spécifié, comme dans les problèmes ci-dessus, les chemins proposés doivent refléter cette contrainte. Ainsi, les options dester de 4-méthyl-2-pentanone et de 3-méthylbutyrate de lexemple 2, bien que tout à fait raisonnables, ne conviennent pas bien avec un départ de tert-butanol. De même, un intermédiaire cyclopentyle pourrait fournir une excellente voie vers le produit dans lexemple 3, mais ne remplit pas les conditions spécifiées du problème.
Lanalyse rétrosynthétique est particulièrement utile lorsque lon considère des molécules relativement complexes sans contraintes de matériau de départ. Si elle est menée sans parti pris, des possibilités inhabituelles et intrigantes apparaissent parfois. Malheureusement, la complexité moléculaire (composée de la taille, de la fonctionnalité, de lincorporation dhétéroatomes, de la connectivité cyclique et de la stéréoisomérie) conduit généralement à des arbres de transformation très grands et largement ramifiés. Lanalyse assistée par ordinateur sest avérée utile, mais en fin de compte, linstinct et lexpérience du chimiste jouent un rôle essentiel dans la réussite dun plan de synthèse. Quelques exemples relativement simples, la plupart ayant des restrictions de matériel de départ, sont fournis ci-dessous.
Exercices
Questions
Q9.9.1
À partir de la 3-hexyne, prédire les voies synthétiques à atteindre:
A – cis-3-hexène
B – 3,4-dibromohexane
C – 3-hexanol
Q9.9.2
À partir de lacétylène et de tout halogénure dalkyle, proposer une synthèse pour faire (a) du pentanal et (b) de lhexane.
Solutions
S9.9.1

S9.9.2
.png?revision=1)
Contributeurs et Attributions
-
Dr. Dietmar Kennepohl FCIC (Professeur de chimie, Université Athabasca)
-
Prof. Steven Farmer (Université dÉtat de Sonoma)
-
William Reusch, professeur émérite (Michigan State U.), Manuel virtuel de chimie organique