12.2: Rapports molaires
Rapports molaires
Les problèmes de stœchiométrie peuvent être caractérisés par deux choses: (1) les informations données dans le problème, et (2) les informations à résoudre, appelées linconnu. Le donné et linconnu peuvent tous deux être des réactifs, tous deux être des produits, ou lun peut être un réactif tandis que lautre est un produit. Les quantités de substances peuvent être exprimées en moles. Cependant, dans une situation de laboratoire, il est courant de déterminer la quantité dune substance en trouvant sa masse en grammes. La quantité dune substance gazeuse peut être exprimée par son volume. Dans ce concept, nous nous concentrerons sur le type de problème où les quantités données et inconnues sont exprimées en moles.

Les équations chimiques expriment les quantités de réactifs et de produits dans a réactifs et produits dans une réaction. Les coefficients dune équation équilibrée peuvent représenter soit le nombre de molécules, soit le nombre de moles de chaque substance. La production dammoniac \ (\ left (\ ce {NH_3} \ right) \) à partir dazote et dhydrogène gazeux est une réaction industrielle importante appelée procédé Haber, daprès le chimiste allemand Fritz Haber.
\
Léquation équilibrée peut être analysée de plusieurs manières, comme le montre la figure ci-dessous.
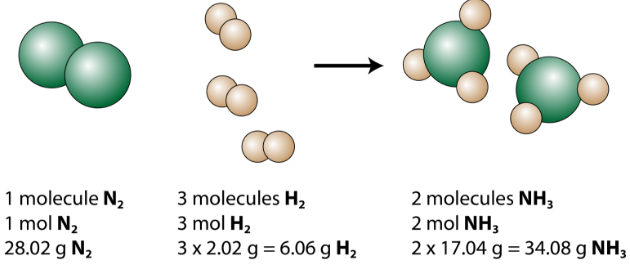
On voit quune molécule dazote réagit avec 3 molécules dhydrogène pour former 2 molécules dammoniac. Il sagit de la plus petite quantité relative possible de réactifs et de produits. Pour prendre en compte des quantités relatives plus importantes, chaque coefficient peut être multiplié par le même nombre. Par exemple, 10 molécules dazote réagiraient avec 30 molécules dhydrogène pour produire 20 molécules dammoniac.
La quantité la plus utile pour compter les particules est la mole. Donc, si chaque coefficient est multiplié par une mole, léquation chimique équilibrée nous dit quune mole dazote réagit avec 3 moles dhydrogène pour produire 2 moles dammoniac. Cest la manière conventionnelle dinterpréter toute équation chimique équilibrée.
\
La masse et le nombre datomes doivent être conservés dans toute réaction chimique. Le nombre de molécules nest pas nécessairement conservé.

Un rapport molaire est un facteur de conversion qui relie les quantités en moles de deux substances quelconques dans une réaction chimique. Les nombres dans un facteur de conversion proviennent des coefficients de léquation chimique équilibrée. Les six rapports molaires suivants peuvent être écrits pour la réaction de formation dammoniac ci-dessus.
Dans un problème de rapport molaire, la substance donnée, exprimée en moles, est écrite en premier. Le facteur de conversion approprié est choisi afin de convertir des moles de la substance donnée en moles de linconnu.