Remodeled CAR T-soluterapia vähentää sivuvaikutuksia ensimmäisessä kliinisessä tutkimuksessa
20. helmikuuta 2020, NCI: n henkilöstö
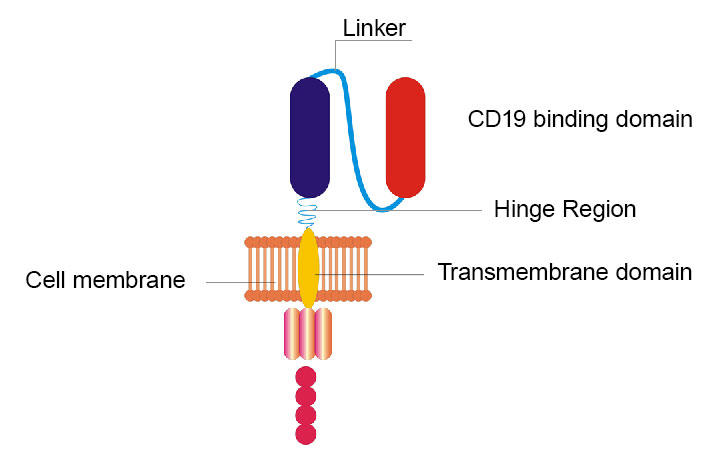
NCI: n tutkijat uudistivat alkuperäisen CD19 CAR: nsa korvaamalla saranan ja transmembraanidomeenit ja CD19: tä sitovan domeenin vaihtaminen hiiristä löydetystä proteiinifragmentista samanlaiseen fragmenttiin, joka löytyy ihmisistä.
Useiden vuosikymmenien aikana NCI: n tutkijat loivat laajan pohjan romaanille hoito, josta lopulta tulee axiksabtagene ciloleucel (Yescarta), CAR T-soluterapia aikuisille, joilla on lymfooma.
Vaikka hoito voi johtaa pitkäkestoisiin remissioihin joillekin potilaille, joilla on pitkälle edennyt syöpä, se voi myös aiheuttaa neurologisia sivuvaikutuksia, kuten puheongelmia, vapinaa, deliriumia ja kohtauksia. Jotkut haittavaikutukset voivat olla vakavia tai kohtalokkaita.
Joten vuonna 2017 NCI-tutkijat muokkaivat alkuperäistä CAR T-solusuunnittelua tavoitteena luoda turvallisempi ja tehokkaampi hoito. Uudistettujen CAR-T-solujen ensimmäisen kliinisen tutkimuksen tulokset viittaavat siihen, että ne ovat saattaneet saavuttaa osan tavoitteestaan.
Uusi hoito aiheutti paljon vähemmän neurologisia sivuvaikutuksia kuin alkuperäinen hoito edellisessä tutkimuksessa, silti se oli yhtä tehokas. Tulokset raportoitiin 20. tammikuuta Nature Medicine -lehdessä.
”On huomattavaa, että tämän tutkimuksen 20 potilaasta vain yhdellä oli vakavia neurologisia sivuvaikutuksia”, kertoi apulais tutkija Jennifer Brudno, NCI: n NCI: n keskus Syöpätutkimus.
”Tämä näyttää olevan merkittävä edistysaskel nykyisessä käsityksessämme siitä, miten CAR T-solut toimivat ja miten tehdä turvallisemmista CAR T-soluista”, sanoo lääketieteen tohtori David Maloney, lääketieteellinen johtaja. Fred Hutchinsonin syöpätutkimuskeskuksen soluimmunoterapian johtaja, joka ei ollut mukana tutkimuksessa.
Tutkimusta rajoittaa kuitenkin pieni osallistuvien potilaiden määrä ja potilaiden tuloksia on seurattu suhteellisen lyhyessä ajassa, hän lisäsi.
T-solut saavat uuden CAR
CAR-T-soluhoito käsittää potilaan omien T-solujen (eräänlaisten valkosolujen) virittämisen erikoistuneella proteiinilla, jota kutsutaan CAR: ksi tai kimeeriseksi antigeenireseptori. Tämä reseptori auttaa T-soluja löytämään ja tappamaan henkilön syövän.
NCI-tiimin uusittu CAR eroaa alkuperäisestä muutamalla tavalla. Esimerkiksi alkuperäisen CAR: n kaksi osaa (nimeltään sarana- ja kalvon läpäisevät domeenit) korvattiin. Ja toinen osa, joka koostui alun perin hiiristä löydetystä proteiinifragmentista, vaihdettiin samanlaiseen fragmenttiin, joka löytyy ihmisistä. Mutta kuten alkuperäinen, uusi CAR kohdistaa myös CD19: n, molekyylin, joka tutkii lymfoomasolujen pintaa.
Aikaisemmissa laboratoriotutkimuksissa tutkijat havaitsivat, että uudella CAR: lla varustetut T-solut hidastivat kasvainten kasvua hiirissä. Ja verrattuna alkuperäisiin CAR T-soluihin uudet CAR T-solut tuottivat matalampia aineita, joita kutsutaan sytokiineiksi.
Tutkijat eivät täysin ymmärrä, miten CAR T-solut aiheuttavat neurologisia sivuvaikutuksia, mutta sytokiinit saattavat olla osittain syyttää. Sytokiinit ovat myös syyllisiä sytokiinien vapautumisoireyhtymään, joka on toinen potentiaalisesti hengenvaarallinen CAR T-soluhoidon sivuvaikutus.
Näillä lupaavilla tuloksilla joukkue eteni uusittujen CAR-T-solujen ensimmäisessä tutkimuksessa ihmisessä.
Vähemmän sytokiineja, vähemmän neurologisia sivuvaikutuksia
Uudessa tutkimuksessa tohtori Brudno ja hänen kollegansa antoivat uuden CAR T-soluterapian 20 potilaalle, joilla oli B-solulymfooma.
Kaiken kaikkiaan neljällä potilaalla (20%) esiintyi jonkin verran neurologista toksisuutta: Kolmella oli lieviä vaikutuksia ja yhdellä (5%) vakavia vaikutuksia, jotka hävisivät nopeasti steroidihoidon jälkeen (lääke, joka heikentää immuunijärjestelmää) ).
Aikaisemmassa tutkimuksessa alkuperäisestä CAR-T-soluhoidosta, johon osallistui 22 B-solulymfoomaa sairastavaa henkilöä, 17: llä (77%) oli jonkin verran neurologista toksisuutta – mukaan lukien 11 potilasta (50%), joilla oli vakavia oireita.
Kaksi potilasta (10%) uudessa tutkimuksessa ja neljä (18%) aiemmassa tutkimuksessa oli vaikea sytokiinien vapautumisoireyhtymä. ”Vaikuttaa suotuisalta, että samanlainen, mutta on vaikea sanoa, tuleeko se ehdottomasti harvemmin” uudella hoidolla, tohtori Brudno sanoi.
Sytokiinitasot olivat alhaisemmat uudella hoidolla hoidettujen potilaiden veressä. kuin potilailla, jotka saivat alkuperäisen hoidon, tutkijat löysivät, mikä saattaa selittää, miksi uusi hoito aiheutti vähemmän neurologisia sivuvaikutuksia, he kirjoittivat.
Molemmissa tutkimuksissa tutkijat käyttivät samoja menetelmiä vakavuuden arvioimiseksi. neurologisen toksisuuden ja sytokiinien vapautumisoireyhtymän, tohtori Brudno totesi.
Vaikka näiden kahden kokeen välillä on muitakin yhtäläisyyksiä – ne tehtiin esimerkiksi samassa laitoksessa -, on hankalaa verrata riippumattomien tutkimusten tuloksia, hän sanoi.
CAR T-solut, jotka tarttuvat ympärille
Yksi ongelma nykyisissä CAR T-soluhoidoissa on, että solut eivät kestä kovin kauan potilaan kehossa. Tämä johtuu osittain siitä, että ihmisen immuunijärjestelmä voi nähdä hiiren proteiinit tuntemattomina ja tuhota CAR T-solut.
Osa joukkueen tavoitteista oli luoda CAR T -soluja, jotka pysyvät kiinni tai pysyvät pidempään. He päättelivät, että T-solut, joissa CAR oli valmistettu kaikista ihmisen proteiineista, saattavat kestää kauemmin kuin solut, joissa CAR sisältää hiiren proteiineja.
Jos potilaan immuunijärjestelmä jättää huomiotta ihmisen proteiineista tehdyn CAR: n, CAR T-solut saattavat kestää kauemmin ja olla tehokkaampia, tohtori Brudno selitti.
Näin voi olla uutta hoitoa varten. Kuukauden kuluttua hoidon aloittamisesta uuden T-hoidon saaneiden potilaiden veressä oli korkeampi CAR T-solupitoisuus kuin alkuperäisellä hoidolla.
Nämä havainnot ovat ”rohkaisevia” ja niiden pitäisi olla tulevissa tutkimuksissa, tohtori Maloney sanoi.
Vaikka uudet CAR-T-solut näyttävät kestävän kauemmin kuin alkuperäiset CAR-solut, ne eivät vaikuttaneet olevan tehokkaampia. Molemmissa tutkimuksissa yli puolet (55%) osallistujista meni täydelliseen remissioon.
Mutta on ”rohkaisevaa” nähdä ”erittäin hyvä tehokkuus tälle CAR T-solutuotteelle vähäisen toksisuuden lisäksi”, tohtori Brudno sanoi.
Informatiivinen uudelleensuunnittelu
CAR T-soluterapia voi johtaa monenlaisiin neurologisiin vaikutuksiin, jotka vaihtelevat hyvin lievistä vaikeisiin ja hengenvaarallisiin, tohtori Brudno selitti.
Nämä haittavaikutukset liittyvät kaikkiin tällä hetkellä saatavilla oleviin CAR T-soluterapioihin – kaksi FDA: n hyväksymää ja toinen odottaa FDA: n hyväksyntää – tohtori Maloney totesi. vakavien neurologisten toksisuuksien määrät ovat vaihdelleet 5%: sta 50%: iin.
Muissa kliinisissä tutkimuksissa testataan CAR T-soluterapioita, jotka on myös suunniteltu uudelleen turvallisemmiksi, tohtori Maloney totesi. Uusi NCI-tutkimus yksilöi CAR T-solusuunnittelun näkökohdat, joiden ei aiemmin tiedetty vaikuttavan neurologiseen toksisuuteen, hän sanoi.
”Mutta kuinka kääntää se uudeksi kaupalliseksi tuotteeksi tai päivittää kaupallinen tuote, on aivan toinen kysymys”, hän sanoi. CAR T-soluterapian valmistaminen jokaiselle potilaalle on monimutkainen ja kallis prosessi, joka voidaan tehdä vain hyvin erikoistuneissa tiloissa.
Toistaiseksi NCI-tiimi, johtajana MD James Kochenderfer, keskittyy kliinisten tutkimusten suorittamiseen erilaisista CAR T-soluterapioista ihmisille, joilla on toinen verityyppi syöpä, multippeli myelooma.