12.2: Moolisuhteet
Moolisuhteet
Stöhikiometrian ongelmille voidaan luonnehtia kahta asiaa: (1) tehtävässä annetut tiedot ja (2) tiedot, jotka on ratkaistava, joita kutsutaan tuntemattomiksi. Annetut ja tuntemattomat voivat molemmat olla reagoivia aineita, molemmat tuotteita tai toinen voi olla reagoivia aineita, kun taas toinen on tuote. Aineiden määrät voidaan ilmaista moolina. Laboratoriotilanteessa on kuitenkin yleistä määrittää aineen määrä löytämällä sen massa grammoina. Kaasumaisen aineen määrä voidaan ilmaista sen tilavuutena. Tässä käsitteessä keskitymme ongelmatyyppiin, jossa sekä annettu että tuntematon määrä ilmaistaan moolina.

Kemialliset yhtälöt ilmaisevat reagenssien ja tuotteiden määrät reaktantit ja tuotteet reaktiossa. Tasapainotetun yhtälön kertoimet voivat edustaa joko molekyylien tai kunkin aineen moolien lukumäärää. Ammoniakin \ (\ vasen (\ ce {NH_3} \ oikea) \) tuotanto typestä ja vetykaasuista on tärkeä teollinen reaktio, jota kutsutaan Haber-prosessiksi saksalaisen kemisti Fritz Haberin mukaan. p>
Tasapainoinen yhtälö voidaan analysoida useilla tavoilla, kuten alla olevassa kuvassa näkyy.
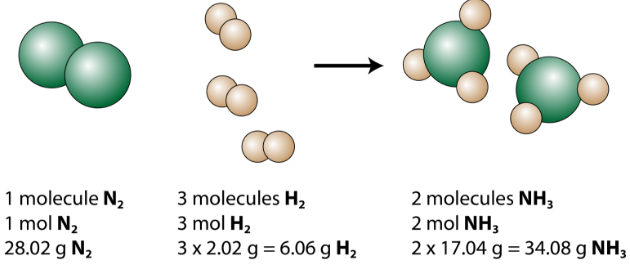
Näemme, että yksi typpimolekyyli reagoi kolmen vetymolekyylin kanssa muodostaen 2 ammoniakkimolekyyliä. Tämä on pienin mahdollinen reagenssien ja tuotteiden suhteellinen määrä. Suurempien suhteellisten määrien huomioon ottamiseksi kukin kerroin voidaan kertoa samalla luvulla. Esimerkiksi 10 typpimolekyyliä reagoisi 30 vetymolekyylin kanssa tuottamaan 20 ammoniakkimolekyyliä.
Hyödyllisin määrä hiukkasten laskemiseen on mooli. Joten jos kukin kerroin kerrotaan moolilla, tasapainotettu kemiallinen yhtälö kertoo meille, että 1 mooli typpeä reagoi 3 moolin kanssa vetyä tuottamaan 2 moolia ammoniakkia. Tämä on tavanomainen tapa tulkita mikä tahansa tasapainoinen kemiallinen yhtälö.
\
Massa ja atomien määrä on säilytettävä kaikissa kemiallisissa reaktioissa. Molekyylien määrää ei välttämättä säilytetä.

Moolisuhde on muuntokerroin, joka kertoo minkä tahansa kahden kemiallisen reaktion aineen määrän moolina. Muuntokertoimen luvut tulevat tasapainotetun kemiallisen yhtälön kertoimista. Seuraavat kuusi moolisuhdetta voidaan kirjoittaa yllä olevalle ammoniakin muodostumisreaktiolle.
Moolisuhdeongelmassa annettu aine kirjoitetaan ensin moolina. Sopiva muuntokerroin valitaan, jotta se voidaan muuntaa annetun aineen moolista tuntemattoman mooliksi.