Parálisis isquémica del tercer nervio autorresoluble
El paciente se presentó a su oftalmólogo aproximadamente cuatro meses después con diplopía binocular y notó que los síntomas del ojo derecho estaban afectando su capacidad para leer y conducir. También desarrolló dolores de cabeza debido a la contracción tónica del músculo frontal en un intento de levantar el párpado superior derecho. El examen mostró una motilidad extraocular limitada de su ojo derecho (OD) en todas las direcciones que parecía peor que la presentación anterior. El resto de su examen físico no tuvo nada de especial. El análisis de laboratorio, incluida la VSG y la PCR, no fue notable.
Historial ocular anterior
- Cirugía de cataratas en ambos ojos (OU) en 2010
- PDR que requirió oftalmoscopia indirecta con láser OD y vitrectomía pars plana con PRP endoláser del ojo izquierdo (OS) en 2017
- Ozurdex OU (7 semanas OD y 15 semanas OS desde la última implantación) desde 2017
- Inyecciones intravítreas de Avastin desde 2012
Historial médico anterior
- Diabetes mellitus tipo 2 durante más de 10 años con PDR además de neuropatía periférica y pie izquierdo amputación debido a una úlcera que no cicatriza. La hemoglobina A1c más reciente fue del 9,3%.
- Hipertensión
- Hiperlipidemia
Medicamentos
- Aspirina 81 mg 1 tableta al día por vía oral
- Insulina detemir 100 unidades / ml inyectar 30 unidades al acostarse por vía subcutánea
- Insulina glargina 100 unidades / ml inyectar 30 unidades al acostarse por vía subcutánea
- Metformina 500 mg 3 comprimidos al día por vía oral
- Ondansetron 4 mg según sea necesario por vía oral
- Sitagliptina 100 mg 1 comprimido al día por vía oral
Alergias
Sin alergias conocidas
Historia familiar
- Madre y hermano con antecedentes de diabetes tipo 2
- Hermano con antecedentes de hipertensión
Historia social
- Tabaco: historial de tabaquismo de 2.5 paquetes al año, dejar de fumar a principios de la década de 2000
- Alcohol: 1-2 bebidas por semana
Revisión de sistemas
Negativo, excepto según se indique en la historia de la enfermedad actual. El paciente negó específicamente pérdida de peso, claudicación mandibular, dolor a la palpación del cuero cabelludo y fatiga.
EXAMEN OCULAR
Agudeza visual con corrección (Snellen)
- OD : 20/40, sin mejoría con el orificio
- OS: 20/30, sin mejoría con el orificio
Motilidad / alineación ocular
- OD:
| -3 | -3 | -3 |
| 0 | -4 | |
| -1 | -1 | -1 |
- SO: completo
Presión intraocular (Tonopen)
- OD: 20 mmHg
- OS: 16 mmHg
Pupilas
- OD: 3 mm (oscuro) → 2 mm (claro) sin defecto pupilar aferente relativo (R APD)
- OS: 3 mm (oscuro) → 2 mm (claro) sin RAPD
Externo
OU: Movimiento frontal normal
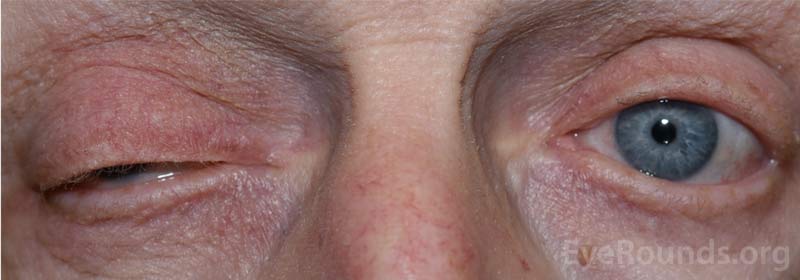
Figura 1: Fotografía externa que demuestra la ptosis del párpado superior derecho.
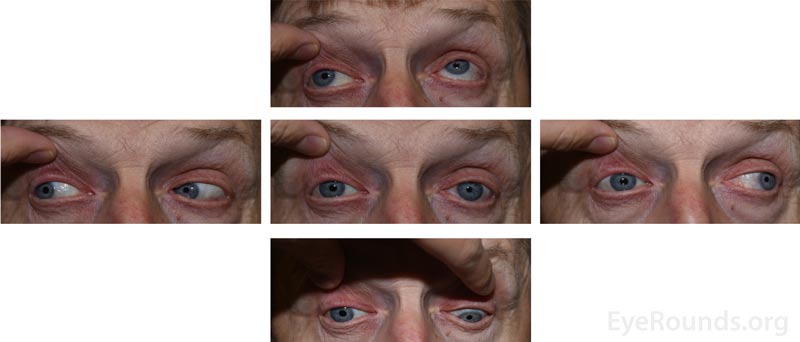
Figura 2: Fotografías externas de 5 miradas que demuestran la disminución de la motilidad del ojo derecho en todas las direcciones excepto en la abducción.
Examen con lámpara de hendidura
- Párpados / pestañas: ptosis completa
- Conjuntiva / esclerótica: clara y silenciosa
- Córnea: transparente
- Cámara anterior: profunda y silencioso
- Iris: arquitectura normal
- Lente: lente intraocular de cámara posterior (PCIOL)
- SO
- Párpados / pestañas: Normal
- Conjuntiva / esclerótica: clara y silenciosa
- Córnea: transparente
- Cámara anterior: profunda y silenciosa
- Iris : Arquitectura normal
- Lente: PCIOL
Examen de fondo de ojo dilatado (DFE)
- OD:
- Vítreo: D implante de exametasona (Ozurdex®) en la parte inferior
- Disco: neovascularización normal, regresiva del disco (NVD), gliosis
- Relación copa / disco: 0,4
- Mácula: edema macular diabético (DME) presente pero ninguno dentro de un diámetro de disco de la fóvea
- Vasos: sin oclusiones importantes, atenuada
- Periferia: unida con cicatrices de PRP
- SO:
- Vítreo: implante de dexametasona (Ozurdex®) en la parte inferior
- Disco: Normal
- Relación copa / disco : 0.4
- Mácula: sin edema macular clínicamente significativo
- Vasos: sin oclusiones importantes, atenuadas
- Periferia: cicatrices de PRP pesadas
Diagnóstico diferencial
- Miastenia gravis
- Enfermedad ocular tiroidea
- Oftalmoplejía externa progresiva crónica
- Oftalmoplejía internuclear
- Desviación oblicua
- Isquemia microvascular secundaria a diabetes
- Compresión por una masa (es decir, tumor o absceso)
- Fístula carotídea cavernosa
- Enfermedad desmielinizante (es decir, esclerosis múltiple)
- Enfermedad granulomatosa (es decir, sarcoidosis)
- Arteritis de células gigantes (u otros tipos de vasculitis)
- Neurosífilis
- Trombosis del seno cavernoso
- Historial reciente de cirugía cerebral
- Efecto secundario del fármaco (es decir, infliximab)
- Trauma
- Aneurisma
- Accidente cerebrovascular
CURSO CLÍNICO
La presentación fue consistente con una parálisis secundaria del tercer par craneal con preservación de la pupila derecha a hipertensión y diabetes mal controladas. El estudio previo realizado por neurología cuatro meses antes fue negativo para una masa, aneurisma o accidente cerebrovascular. Se determinó que la parálisis del tercer par era de naturaleza isquémica y se le dieron estrictas precauciones para el retorno, como la progresión de los síntomas o la afectación de la pupila. En la visita de retorno tres meses después, la ptosis del párpado superior derecho y los déficits de motilidad se habían resuelto por completo. Se le animó a hablar sobre el manejo de la diabetes y la hipertensión con su proveedor de atención primaria, y continuar con el seguimiento con el oftalmología con respecto al manejo de la PDR.
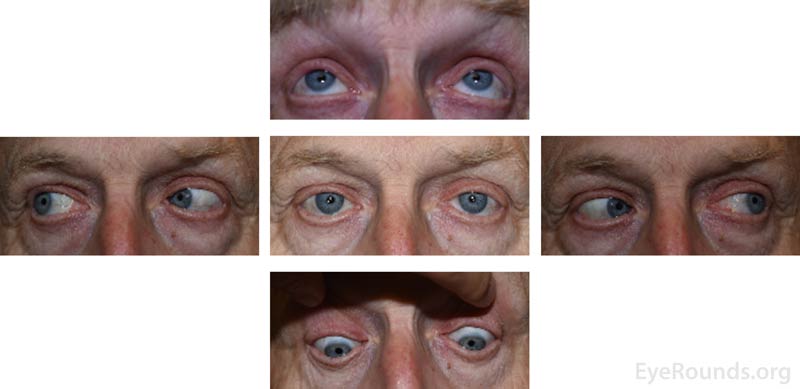
Figura 3: Fotografías externas de 5 miradas tomadas en la cita de seguimiento cuatro meses después del inicio de los síntomas que demuestran extraocular completo motilidad y sin ptosis bilateral.
DIAGNÓSTICO
Parálisis del III par craneal con preservación de pupila isquémica del lado derecho
DISCUSIÓN
Etiología / Epidemiología
La parálisis adquirida del tercer par, que a menudo se presenta con ptosis y el ojo en una posición «hacia abajo y hacia afuera», tiene un diagnóstico diferencial amplio que incluye daño microvascular, tumores, aneurismas, posneurocirugía y trauma. La incidencia de parálisis adquirida del tercer par se estima en aproximadamente cuatro por 100.000, siendo la isquemia microvascular la causa más común, que comprende el 42% de los casos.
Anteriormente se estimaba que el aneurisma como causa de la parálisis del tercer par craneal era del 10 al 30%, pero estimaciones más recientes han situado la frecuencia en aproximadamente el seis por ciento. Los tumores comprenden alrededor del 11% de los casos de parálisis del tercer par, mientras que los traumatismos representan alrededor del 12% de los casos. Cuando hay una parálisis del tercer par sin afectación de la pupila, esto es más sugestivo de isquemia microvascular, una complicación que a menudo se observa en diabéticos mal manejados. Además, otra causa importante de parálisis isquémica del tercer par es la vasculitis, en particular la arteritis de células gigantes (ACG).
Fisiopatología
La isquemia microvascular secundaria a la diabetes se debe a una lesión del nervio periférico y el flujo de sangre. La lesión del nervio periférico es el resultado final del daño osmótico causado por la acumulación de sorbitol y los productos finales de glicación avanzada (AGE). Los AGE provocan estrés oxidativo principalmente a través de la activación de NADPH oxidasa, y esto a su vez puede conducir a la apoptosis de los tejidos nerviosos afectados, como las células de Schwann, las fibras nerviosas y las células endoteliales del vaso vasorum. La isquemia daña inicialmente las fibras motoras centrales del III par craneal. Se cree que esto ocurre porque la arteria que irriga el III par craneal está ubicada en el centro. Por el contrario, las fibras parasimpáticas viajan superficialmente a lo largo de la porción medial del III par craneal. Las fibras parasimpáticas que median en la miosis comienzan en el núcleo de Edinger-Westphal y sus axones recorren la periferia del III par craneal para hacer sinapsis con las células posganglionares en el ganglio ciliar (ver Figura 4). El ganglio ciliar contiene axones que ingresan al ojo a través de los nervios ciliares cortos, que inervan el esfínter pupilar, el músculo que conduce a la constricción de la pupila. En el caso de las parálisis microvasculares del tercer nervio, dado que las fibras nerviosas parasimpáticas se encuentran más alejadas del vaso sanguíneo isquémico, en la mayoría de los casos se afectan mucho más tarde o se salvan por completo. Esto resulta en una parálisis del tercer par con una pupila reactiva y no dilatada.
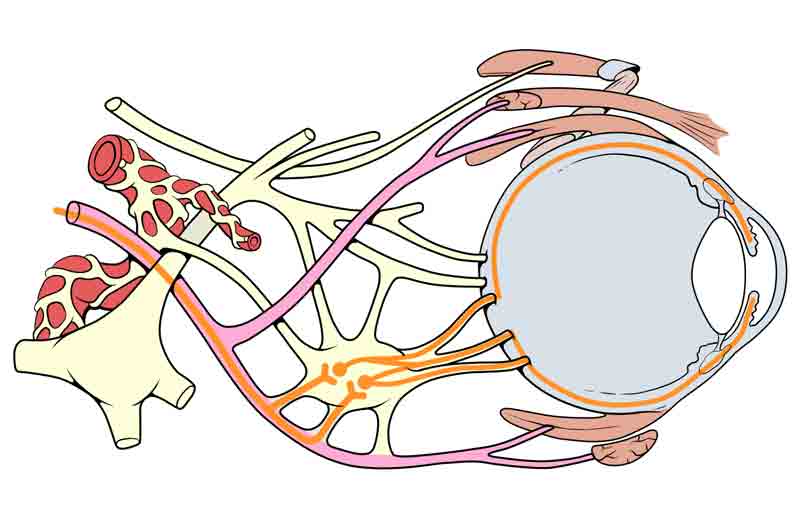
Figura 4: Usada con permiso, Patrick J. Lynch, ilustrador médico; C. Carl Jaffe, MD, cardiólogo. https://creativecommons.org/licenses/by/2.5/. Diagrama anatómico que demuestra la estrecha proximidad de las fibras nerviosas parasimpáticas con el nervio motor ocular común. Tenga en cuenta que el ganglio ciliar es donde se produce la sinapsis parasimpática y las fibras nerviosas posganglionares viajan para inervar el músculo esfínter de la pupila, lo que permite la constricción pupilar.
Signos / Síntomas
Una parálisis del tercer nervio comúnmente se presenta con el ojo en una posición abducida y deprimida («hacia abajo y hacia afuera») debido a la acción sin oposición del recto lateral y el oblicuo superior músculos. El paciente a menudo experimenta diplopía binocular si el párpado no está completamente ptótico y bloquea el eje visual. Debido a que las fibras nerviosas parasimpáticas generalmente se conservan, la pupila generalmente no está dilatada y responde a la luz. Una de las etiologías más graves que causan la parálisis del tercer par es un aneurisma de la arteria comunicante posterior, que a menudo se presenta con una pupila dilatada. Este escenario clínico a menudo se conoce como la «regla de la pupila», lo que significa que una pupila dilatada en el contexto de una parálisis del tercer par es un signo ominoso que a menudo se asocia con una lesión compresiva. Sin embargo, es importante señalar que la regla del alumno no siempre se cumple. Los pacientes con aneurismas pueden presentarse sin afectación pupilar y los pacientes con parálisis microvascular isquémica del tercer par craneal pueden tener afectación pupilar. En el caso de un examen dudoso o antecedentes médicos incompatibles con una enfermedad microvascular, es prudente obtener imágenes para descartar causas como un aneurisma o un tumor.
Pruebas / Análisis de laboratorio
Al diagnosticar una parálisis del tercer par, se realiza un examen ocular completo, que incluye reactividad pupilar, motilidad extraocular, posición de los párpados y campos visuales de confrontación. Además, deben evaluarse todos los nervios craneales (2). Si se sospecha miastenia gravis, se debe realizar la prueba de hielo o la prueba de Tensilon (se pueden encontrar más detalles sobre las pruebas de miastenia gravis aquí). Si se sospecha ACG, es importante obtener un nivel de proteína C reactiva, velocidad de sedimentación globular y niveles de plaquetas. Si se sospecha enfermedad isquémica, es prudente evaluar la presión arterial del paciente, el nivel de glucosa en sangre en ayunas y la hemoglobina A1c. Si el paciente es un niño, debe solicitarse un hemograma completo con diferencial para evaluar discrasias sanguíneas.
Diagnóstico por imágenes
Actualmente se están debatiendo las prácticas de diagnóstico por imágenes para la posible parálisis isquémica del tercer nervio que preserva la pupila. Algunas fuentes sugieren obtener una tomografía computarizada de la cabeza o una angiografía por tomografía computarizada, y solo solicitar una resonancia magnética de la cabeza si o la angiografía por TC no están disponibles o están contraindicadas. Sin embargo, la modalidad de imagen inicial más comúnmente utilizada es la resonancia magnética. En casos de sospecha de hemorragia subaracnoidea o trauma, una tomografía computarizada puede ser el método preferido. el paciente tiene más de 10 años y los estudios de imágenes previos son equívocos. Los estudios han demostrado que es más probable que los neurólogos que los oftalmólogos soliciten imágenes de resonancia magnética en pacientes que presentan parálisis del tercer par.
La decisión de solicitar una resonancia magnética para un paciente con una parálisis del tercer par craneal que preserva la pupila depende de la historia clínica. Algunos estudios sugieren que la solicitud de una resonancia magnética para una parálisis del tercer par craneal debe realizarse en pacientes sin antecedentes de diabetes o hipertensión, ya que es probable que una causa no isquémica sea mayor sin factores de riesgo. Por el contrario, los pacientes con sospecha de parálisis isquémica del tercer par que tienen antecedentes de diabetes o hipertensión pueden observarse inicialmente con la opción de imágenes de resonancia magnética si no ha habido mejoría después de tres meses. Se ha demostrado que la resonancia magnética como prueba de diagnóstico tiene alguna utilidad clínica, con un estudio que obtuvo una resonancia magnética del cerebro de 43 pacientes con una parálisis del tercer par que preservaba la pupila y mostró una causa identificable en 25 casos.
Tratamiento / Manejo / Pautas
El manejo de la parálisis isquémica del tercer par craneal es una observación expectante, ya que la afección suele ser autolimitada y la atención se centra en abordar los factores de riesgo. Las intervenciones adecuadas incluyen el control de la glucosa en sangre, la presión arterial y los niveles de lípidos. Si bien la parálisis isquémica del tercer par puede ser debilitante para los pacientes, los síntomas se resuelven por completo en el 80-85% de los pacientes en un período de tres a seis meses. Sin embargo, si la afección no se resuelve o el paciente desea un alivio sintomático en el período intermedio, existen varias opciones de tratamiento. Las opciones para manejar la diplopía incluyen ocluir el ojo afectado con un parche o lente opaca o colocar un prisma de Fresnel cuando el recto medial todavía tiene función residual. Sin embargo, debe tenerse en cuenta que a veces se desaconseja el uso de parches en niños menores de ocho años debido al riesgo de desarrollar ambliopía, y los oftalmólogos pediátricos de la Universidad de Iowa no recomiendan el uso de prismas en niños en absoluto.
La toxina botulínica en el recto lateral es otra opción durante la fase aguda de una parálisis del tercer par y se ha demostrado que es especialmente útil en casos aislados de afectación del recto medial. La toxina actúa debilitando el recto lateral, equilibrando la parálisis del recto medial.La terapia con toxina botulínica está indicada con menos frecuencia para el desequilibrio muscular vertical, ya que se ha demostrado que tiene más complicaciones, a saber, debilidad o rigidez muscular.
Si el tratamiento no quirúrgico falla y el paciente no resuelve los síntomas en seis meses, Se puede realizar cirugía de estrabismo (19). Se desea una estabilidad documentada de los déficits residuales en la motilidad extraocular antes de proceder con la cirugía correctiva. La cirugía de blefaroptosis también se puede realizar para corregir cualquier ptosis residual asociada con una parálisis del tercer par (20). La parálisis del tercer par tiene muchos abordajes quirúrgicos diferentes según la gravedad de la parálisis. Las opciones incluyen la resección conjuntival del músculo (MMCR) de Müller, el avance del elevador y el cabestrillo frontal, como se describe en este artículo relacionado de EyeRounds.
EPIDEMIOLOGÍA O ETIOLOGÍA
|
SIGNOS
|
SÍNTOMAS
|
TRATAMIENTO / MANEJO
|