La terapia de células T CAR remodelada reduce los efectos secundarios en el primer ensayo clínico
20 de febrero de 2020, por personal del NCI
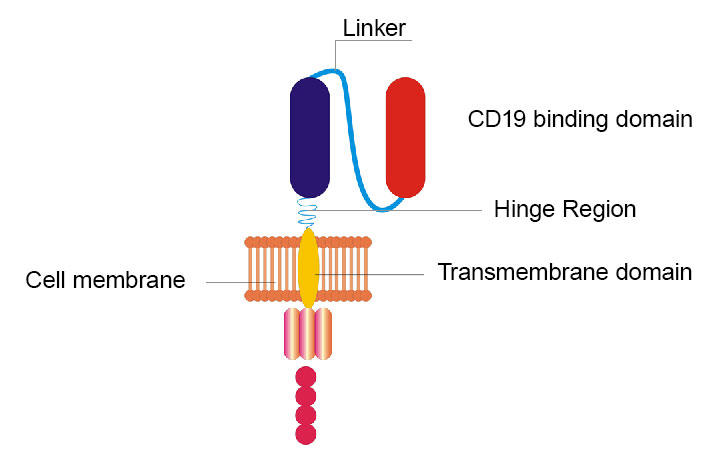
Los investigadores del NCI remodelaron su CAR CD19 original reemplazando la bisagra y dominios transmembrana e intercambiando el dominio de unión de CD19 de un fragmento de proteína que se encuentra en ratones a un fragmento similar que se encuentra en humanos.
En el transcurso de varias décadas, los científicos del NCI sentaron las bases para una novela tratamiento que eventualmente se convertiría en axicabtagene ciloleucel (Yescarta), una terapia de células T con CAR para adultos con linfoma.
Si bien la terapia puede conducir a remisiones duraderas para algunos pacientes con cáncer muy avanzado, también puede causar efectos secundarios neurológicos como problemas del habla, temblores, delirio y convulsiones. Algunos efectos secundarios pueden ser graves o fatales.
Entonces, en 2017, los investigadores del NCI modificaron su diseño original de células T CAR con el objetivo de crear una terapia más segura y efectiva. Ahora, los resultados del primer ensayo clínico de las células CAR T remodeladas sugieren que pueden haber logrado parte de su objetivo.
La nueva terapia causó muchos menos efectos secundarios neurológicos que la terapia original en un ensayo anterior. sin embargo, fue igualmente eficaz. Los hallazgos se publicaron el 20 de enero en Nature Medicine.
«Es notable que de 20 pacientes en este ensayo, solo uno tuvo efectos secundarios neurológicos graves», dijo la investigadora asociada Jennifer Brudno, MD, del Centro de NCI para Investigación del cáncer.
«Esto parece ser un avance significativo en nuestra comprensión actual de cómo funcionan las células CAR T y cómo hacer un CAR T más seguro», dijo David Maloney, MD, Ph.D., médico director de inmunoterapia celular del Fred Hutchinson Cancer Research Center, que no participó en el estudio.
Sin embargo, el estudio está limitado por la pequeña cantidad de pacientes involucrados y la cantidad relativamente corta de tiempo en que se ha realizado un seguimiento de los resultados de los pacientes, agregó.
Las células T obtienen un nuevo CAR
La terapia de células T con CAR implica armar las propias células T del paciente (un tipo de glóbulo blanco) con una proteína especializada llamada CAR, o quimérica receptor de antígeno. Este receptor ayuda a las células T a encontrar y eliminar el cáncer de la persona.
El CAR remodelado del equipo de NCI es diferente del original en algunos aspectos. Por ejemplo, se reemplazaron dos secciones (llamadas dominios bisagra y transmembrana) del CAR original. Y otra sección que originalmente consistía en un fragmento de proteína encontrado en ratones se cambió por un fragmento similar encontrado en humanos. Pero, al igual que el original, el nuevo CAR también se dirige a CD19, una molécula que se adhiere a la superficie de las células del linfoma.
En estudios de laboratorio anteriores, los investigadores encontraron que las células T armadas con el nuevo CAR retardaban el crecimiento de tumores en ratones. Y en comparación con las células CAR T originales, las nuevas células CAR T produjeron niveles más bajos de sustancias llamadas citocinas.
Los científicos no comprenden completamente cómo las células CAR T causan efectos secundarios neurológicos, pero las citocinas pueden ser parcialmente culpar. Las citocinas también son las culpables del síndrome de liberación de citocinas, otro efecto secundario potencialmente mortal de la terapia con células T con CAR.
Con estos resultados prometedores, el equipo avanzó con un primer estudio en humanos de las células CAR T remodeladas.
Menos citocinas, menos efectos secundarios neurológicos
En el nuevo ensayo, la Dra. Brudno y sus colegas administraron la nueva terapia de células T con CAR a 20 pacientes con linfoma de células B.
En general, cuatro pacientes (20%) experimentaron alguna toxicidad neurológica: tres tuvieron efectos leves y uno (5%) experimentó efectos graves que desaparecieron rápidamente después del tratamiento con un esteroide (medicamento que aplana el sistema inmunológico ).
En un estudio anterior de la terapia de células T con CAR original en el que participaron 22 personas con linfoma de células B, 17 (77%) experimentaron alguna toxicidad neurológica, incluidos 11 pacientes (50%) que experimentaron síntomas graves.
Dos pacientes (10%) en el nuevo ensayo y cuatro (18%) en el ensayo anterior tenían síndrome de liberación de citocinas severo. «Parece favorable que similar, pero es difícil decir si definitivamente es menos frecuente» con la nueva terapia, dijo el Dr. Brudno.
Los niveles de citocinas eran más bajos en la sangre de los pacientes tratados con la nueva terapia. que en los pacientes que recibieron la terapia original, encontraron los científicos, lo que podría explicar por qué la nueva terapia causó menos efectos secundarios neurológicos, escribieron.
En ambos ensayos, los investigadores utilizaron los mismos métodos para calificar la gravedad de toxicidad neurológica y síndrome de liberación de citocinas, señaló el Dr. Brudno.
Y aunque existen otras similitudes entre los dos ensayos (por ejemplo, se realizaron en la misma instalación), es complicado comparar los resultados de estudios independientes, dijo.
Células CAR T que se quedan
Un problema con las terapias actuales con células CAR T es que las células no duran mucho en el cuerpo del paciente. Eso se debe en parte a que el sistema inmunológico humano puede ver las proteínas de ratón como desconocidas y destruir las células CAR T.
Parte del objetivo del equipo era crear células CAR T que permanezcan o persistan más tiempo. Razonaron que las células T con un CAR hecho de todas las proteínas humanas podrían durar más que las células con un CAR que contiene proteínas de ratón.
Si el sistema inmunológico del paciente ignora un CAR hecho de proteínas humanas, entonces las células CAR T podrían durar más y ser más efectivas, explicó el Dr. Brudno.
Ese puede ser el caso para la nueva terapia. Un mes después de recibir el tratamiento, había niveles más altos de células CAR T en la sangre de los pacientes que recibieron la nueva terapia que en los tratados con la terapia original.
Estos hallazgos son «alentadores» y deben ser explorado en estudios futuros, dijo el Dr. Maloney.
Aunque las nuevas células CAR T parecen persistir más que las células CAR T originales, no parecen ser más efectivas. En ambos ensayos, más de la mitad (55%) de los participantes entraron en remisión completa.
Pero es «alentador» ver «muy buena eficacia para este producto de células T CAR, además de la baja toxicidad», Dr. Brudno Dijo.
Un rediseño informativo
La terapia de células T con CAR puede producir una amplia gama de efectos neurológicos, que van desde muy leves a graves y potencialmente mortales, explicó el Dr. Brudno.
Estos efectos secundarios están asociados con todas las terapias de células T con CAR disponibles actualmente, dos que están aprobadas por la FDA y otra pendiente de aprobación por la FDA, señaló el Dr. Maloney. En estudios, las tasas de toxicidad neurológica grave han oscilado entre el 5% y el 50%.
Otros ensayos clínicos están probando terapias de células T con CAR que también se han rediseñado para ser más seguras, anotó el Dr. Maloney. El nuevo estudio del NCI identifica aspectos del diseño de las células T CAR que no se sabía que afectaran la toxicidad neurológica, dijo.
«Pero cómo traducir eso en un nuevo producto comercial o actualizar un producto comercial es una cuestión completamente diferente», dijo. La fabricación de una terapia de células T con CAR para cada paciente individual es un proceso complejo y costoso que solo se puede realizar en instalaciones altamente especializadas.
Por ahora, el equipo del NCI, dirigido por el Dr. James Kochenderfer, se centra en realizar ensayos clínicos de diferentes terapias con células T con CAR para personas con otro tipo de sangre cáncer, mieloma múltiple.