Fronteras de la neurociencia humana
Introducción
La conciencia es una excitación y conciencia del medio ambiente y de uno mismo, que se logra mediante la acción del sistema de activación reticular ascendente (ARAS) en el tronco encefálico y la corteza cerebral (Daube, 1986; Paus, 2000; Zeman, 2001; Gosseries et al., 2011). El ARAS se compone de varios circuitos neuronales que conectan el tronco encefálico con la corteza. Estas conexiones neuronales se originan principalmente en la formación reticular (RF) del tronco encefálico y se proyectan a través de relés sinápticos en el núcleo intralaminar del tálamo hacia la corteza cerebral (Daube, 1986; Paus, 2000; Zeman, 2001; Afifi y Bergman, 2005; Gosseries et al., 2011). Además, varios núcleos del tronco encefálico (locus coeruleus, rafe dorsal, rafe medio, núcleo pedunculopontino, núcleo parabraquial), núcleos talámicos inespecíficos, hipotálamo y prosencéfalo basal también se incluyen en el sistema ARAS (Aston-Jones et al., 2001). ; Parvizi y Damasio, 2003; Fuller et al., 2011). La evaluación minuciosa del ARAS es importante para el diagnóstico y el tratamiento de pacientes con alteración de la conciencia, como los pacientes que se encuentran en estado vegetativo o aquellos con conciencia mínima (Zeman, 2001; Gosseries et al., 2011).
La resonancia magnética cerebral convencional, las técnicas de neuroimagen funcional, los métodos electrofisiológicos y la espectroscopia de resonancia magnética se han utilizado en estudios del ARAS en el cerebro humano (Parvizi y Damasio, 2003; Schiff, 2006; Tshibanda et al., 2009, 2010; Gawryluk et al. ., 2010). Sin embargo, debido a que el ARAS no se puede discriminar claramente de las estructuras neuronales adyacentes, la identificación y estimación precisas del ARAS en el cerebro humano pueden ser problemáticas cuando se utilizan estos métodos. Por el contrario, las imágenes por tensor de difusión (DTI) permiten la evaluación de la materia blanca debido a su capacidad para obtener imágenes de las características de difusión del agua (Mori et al., 1999). En la materia blanca normal, las moléculas de agua tienen relativa libertad de movimiento paralela a los tractos de fibras nerviosas. Sin embargo, sus movimientos están restringidos a través de los tractos, dando lugar a la anisotropía de difusión de la sustancia blanca. En consecuencia, la anisotropía de difusión se ha utilizado para evaluar la extensión del cambio de fibra en la materia blanca (Chang et al., 2010; Puig et al., 2010). Varios estudios recientes han intentado demostrar la utilidad de DTI para la evaluación de lesiones en pacientes con deterioro de la conciencia y conectividad de núcleos ARAS específicos en el cerebro humano (Voss et al., 2006; Perlbarg et al., 2009; Tollard et al., 2009; Tshibanda et al., 2009; Fernandez-Espejo et al., 2010, 2011; Newcombe et al., 2010; Edlow et al., 2012). Sin embargo, se sabe poco sobre la reconstrucción y estimación completa del ARAS en el cerebro humano (Edlow et al., 2012).
En el estudio actual, utilizando DTI, intentamos reconstruir el componente único inferior del ARAS desde el RF pontino hasta los núcleos intralaminares del tálamo en el cerebro humano normal.
Materiales y métodos
Sujetos
Veintiséis sujetos sanos normales (14 hombres, 12 mujeres; edad media, 31,85 ± 9,80 años; rango, 20-50) sin antecedentes de enfermedad neurológica fueron reclutados para este estudio. Todos los sujetos participaron en este estudio como voluntarios y proporcionaron su consentimiento por escrito antes de someterse a una exploración DTI. El estudio fue aprobado por la junta de revisión institucional de nuestro hospital.
Imagen del tensor de difusión
Los datos de DTI se adquirieron utilizando una bobina de cabeza de 6 canales en un Philips Gyroscan Intera de 1,5 T ( Philips, Best, Países Bajos) con imágenes ecoplanares de disparo único. Para cada uno de los 32 gradientes de sensibilización de difusión no colineales, adquirimos 67 cortes contiguos paralelos a la línea de comisura anterior-comisura posterior. Los parámetros de imagen fueron los siguientes: matriz de adquisición = 96 × 96, reconstruida a matriz = 128 × 128, campo de visión = 221 mm × 221 mm, TR = 10,726 ms, TE = 76 ms, factor de reducción de imágenes paralelas (factor SENSE) = 2, factor EPI = 49 yb = 1000 s / mm2, NEX = 1 y un grosor de corte de 2,3 mm (tamaño de vóxel isotrópico adquirido 2,3 mm × 2,3 mm × 2,3 mm).
Fibra probabilística Seguimiento
El análisis de los datos de imágenes ponderados por difusión se realizó utilizando la biblioteca de software del Centro de Oxford para la obtención de imágenes por resonancia magnética funcional del cerebro (FMRIB) (FSL; www.fmrib.ox.ac.uk/fsl). Se utilizó un registro bidimensional multiescala afín para corregir el efecto de movimiento de la cabeza y la distorsión de la imagen debido a las corrientes parásitas. El seguimiento de la fibra se realizó utilizando un método de tractografía probabilística basado en un modelo multifibra, y se aplicó en el estudio actual utilizando rutinas de tractografía implementadas en FMRIB Diffusion (5000 muestras aerodinámicas, longitudes de paso de 0,5 mm, umbrales de curvatura = 0,2) (Smith et al., 2004 ).Las ventajas de la tractografía probabilística, que se utilizó en este estudio, incluyen una mayor robustez al ruido, así como la capacidad de detectar vías con ángulos más agudos y distinguir fibras cruzadas (Behrens et al., 2007; Winston et al., 2011).
La ruta del ARAS se determinó mediante la selección de fibras que pasaban a través de las regiones de interés (ROI) de semillas y las ROI objetivo (terminación). Se colocó un ROI semilla en el RF de la protuberancia al nivel de la zona de entrada del nervio trigémino (Daube, 1986; Afifi y Bergman, 2005). Se realizó un análisis del lemnisco medial y el tracto rubroespinal para confirmar el límite del FR en la protuberancia (Figura 1A). Para el análisis del lemnisco medial, se colocaron ROI de semillas en la médula anteromedial y el ROI objetivo se colocó en la corteza somatosensorial (Hong et al., 2010). Para el análisis del tracto rubroespinal, se colocaron ROI de semillas en el núcleo rojo y el ROI de destino se colocó en la región dorsolateral contralateral de la médula (área de Monakow) (Nathan y Smith, 1982; Kwon et al., 2011). El ROI objetivo se administró en los núcleos intralaminares del tálamo a nivel del plano comisural (Morel, 2007). Para definir los núcleos intralaminares del tálamo, nos referimos a un atlas cerebral (Morel, 2007) (Figura 1A). De 5000 muestras generadas a partir del vóxel de siembra, los resultados del contacto se visualizaron en un umbral mínimo de 1 optimizado a través de cada vóxel para análisis. Se midieron los valores de anisotropía fraccionada (FA), difusividad media (DM) y número de tracto del componente individual inferior de ARAS.
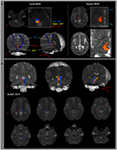
Figura 1. (A) Las regiones de interés de la semilla (ROI) se dan en la formación reticular pontina (color rojo). El ROI objetivo se da en los núcleos intralaminares del tálamo al nivel del plano comisural. El límite de los núcleos intralaminares del tálamo se definió con referencia al libro de texto del atlas cerebral (Morel, 2007). ML, lemnisco medial; RST, tracto rubroespinal; RF, formación reticular; AC, comisura anterior; CP, comisura posterior. (B) Las vías del sistema de activación reticular ascendente reconstruido se muestran en cada nivel del cerebro en un sujeto normal (hombre de 26 años).
Análisis estadístico
Se utilizó el software SPSS (v.15.0; SPSS, Chicago, IL, EE. UU.) para el análisis de datos. Se utilizó la prueba t pareada para determinar la diferencia en los valores de los parámetros DTI del ARAS entre los hemisferios derecho e izquierdo. Se utilizó la prueba de correlación de Pearson para determinar la correlación entre los parámetros DTI del ARAS y la edad. Los resultados se consideraron significativos cuando el valor de p era < 0.05.
Resultados
Reconstruimos el componente individual inferior del ARAS entre el pontino RF y núcleos intralaminares del tálamo. El componente reconstruido del ARAS se originó a partir del RF pontino, ascendió a través del tegmento mesencefálico inmediatamente posterior al núcleo rojo y luego terminó en los núcleos intralaminares del tálamo a nivel del plano comisural en todos los sujetos (Figura 1B).
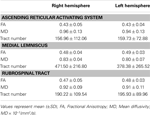
Tabla 1. Parámetros de imagen del tensor de difusión del sistema de activación reticular ascendente .
Discusión
En el estudio actual, utilizando DTI, reconstruimos una de las principales vías de el ARAS, el único componente inferior del ARAS desde el RF hasta el tálamo en sujetos normales, aunque el ARAS consta de núcleos de tronco encefálico adicionales, hipotálamo, prosencéfalo basal y proyecciones tálamocorticales a la corteza cerebral. Seleccionamos dos ROI para la reconstrucción del componente único inferior del ARAS: el ROI semilla, que era el RF de la protuberancia al nivel de la zona de entrada del nervio trigémino (Daube, 1986; Afifi y Bergman, 2005), y el objetivo ROI, que incluía los núcleos intralaminares del tálamo (núcleos laterales centrales, núcleos centromedianos / parafasciculares y núcleos paracentrales) a nivel del plano comisural (Morel, 2007). La porción rostral de la RF del tronco encefálico por encima de la zona de entrada del nervio trigémino se conoce como ARAS; en contraste, la porción caudal de la RF está involucrada en la función motora y la función autónoma relacionada con la función cardíaca y respiratoria (Daube, 1986). Por lo tanto, colocamos el ROI de la semilla en el RF al nivel de la zona de entrada del nervio trigémino. Colocamos el ROI objetivo en los núcleos intralaminares, que son los núcleos principales del ARAS entre los núcleos talámicos inespecíficos. Por lo tanto, creemos que debido a que no pudimos incluir los otros núcleos talámicos relacionados con el ARAS, el componente individual inferior del ARAS que se reconstruyó en el estudio actual no es todo el componente individual inferior del ARAS, sino la porción principal del ARAS. todo el componente individual inferior del ARAS.En consecuencia, el único componente inferior del ARAS se originó en el RF pontino, ascendió a través del tegmento mesencefálico posterior al núcleo rojo y luego terminó en los núcleos intralaminares del tálamo. Además, los valores de FA, MD y los números de los tractos del componente único inferior reconstruido del ARAS no difirieron significativamente entre los hemisferios derecho e izquierdo. El número de tracto está determinado por el número de vóxeles contenidos dentro de un tracto neural (Kwak et al., 2010). El valor de FA indica el grado de direccionalidad e integridad de las microestructuras de la materia blanca como axones, mielina y microtúbulos, y el valor de ADC indica la magnitud de la difusión del agua (Assaf y Pasternak, 2008).
Varios estudios han demostrado la utilidad clínica de la DTI mediante la estimación de algunas áreas del componente único inferior del ARAS desde el FR hasta el tálamo en pacientes con alteración de la conciencia (Perlbarg et al., 2009; Tollard et al., 2009; Newcombe et al., 2010; Fernandez-Espejo et al., 2011). Tollard y col. (2009) informaron sobre la utilidad de la DTI, que se realizó en la etapa subaguda para predecir el resultado en 45 pacientes con TCE grave (lesión cerebral traumática) (ausencia de respuesta a órdenes simples). En su estudio, midieron el valor de FA en varias áreas supratentoriales e infratentoriales, incluidas la protuberancia anterior, la protuberancia posterior y el mesencéfalo, y demostraron que la disminución de la FA infratentorial y supratentorial, excepto en la protuberancia posterior, permitía predecir resultados desfavorables. 1 año desde TBI. Perlbarg y col. (2009), quienes realizaron una exploración con DTI en 30 pacientes con ausencia de respuesta a órdenes simples después de un TCE grave, informaron una disminución definida en la AF medida en el fascículo longitudinal inferior, mesencéfalo (pedúnculo cerebral y tegmento), extremidad posterior de la cápsula interna y cuerpo calloso posterior en el grupo de resultado desfavorable. Newcombe y col. (2010) utilizaron DTI para caracterizar la extensión y ubicación de la pérdida de sustancia blanca en pacientes que estaban en un estado vegetativo secundario a TCE (siete pacientes) y pacientes con lesión isquémico-hipóxica (cinco pacientes). Se observaron anomalías en las áreas supratentoriales en ambos grupos; por el contrario, las anomalías del tronco encefálico se observaron sólo en el grupo de LCT. Fernandez-Espejo et al. (2011) utilizaron DTI en la diferenciación de la neuropatología de 25 pacientes vegetativos y mínimamente conscientes. Llegaron a la conclusión de que los pacientes mínimamente conscientes y los que se encontraban en estado vegetativo diferían en la sustancia blanca subcortical y en las regiones talámicas, pero no parecían diferir en el tallo cerebral. En un estudio reciente que utilizó imágenes de difusión de alta resolución angular, Edlow et al. (2012) informaron sobre la conectividad neuroanatómica del ARAS en el cerebro humano, tanto in vivo como ex vivo. Demostraron que las conectividades de núcleos ARAS específicos estaban implicadas en la excitación, y las de los núcleos talámicos estaban implicados en la modulación de la excitación.
En conclusión, usando DTI, reconstruimos el componente individual inferior de ARAS RF al tálamo en el cerebro humano. Creemos que la metodología utilizada y los resultados de este estudio pueden ser útiles para los investigadores que estudian el ARAS en el cerebro humano. Sin embargo, una de las limitaciones de este estudio es que no pudimos dilucidar completamente todo el sistema ARAS porque no incluimos otros núcleos talámicos y del tronco encefálico en nuestro análisis que también están involucrados en el ARAS. Se necesitan más estudios sobre la utilidad clínica de nuestros hallazgos, así como estudios sobre las proyecciones del ARAS desde el tálamo a la corteza cerebral.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado por DGIST R & Programa D del Ministerio de Educación, Ciencia y Tecnología de Corea (13-BD-0401).
Afifi, AK y Bergman, RA (2005). Neuroanatomía funcional: texto y atlas. Nueva York: Lange Medical Books / McGraw-Hill.
Morel, A. (2007). Atlas estereotáctico del tálamo humano y los ganglios basales. Nueva York: Informa Healthcare.