El desfibrilador cardioversor portátil: un salvavidas (chaleco) de controversia

EE. UU. La Administración de Alimentos y Medicamentos (FDA) aprobó en 2001 un dispositivo médico después de que su ensayo clínico fundamental demostrara seguridad y eficacia en cinco de siete pacientes que recibieron tratamiento.1 Durante más de una década, los estudios observacionales del mundo real con el dispositivo médico describieron variaciones interpretaciones de utilidad.
En 2018, 17 años después de la aprobación de la FDA, los resultados del primer ensayo controlado aleatorio del dispositivo médico revelaron resultados negativos.2 Hasta el día de hoy, este dispositivo médico continúa recetándose y , en ciertas instituciones, se ha convertido en el estándar de atención. Esta es la historia de LifeVest®, el único desfibrilador cardioversor portátil (WCD) aprobado por la FDA, indicado para reducir el riesgo de muerte cardíaca súbita (MSC) en pacientes con fracción de eyección ventricular izquierda reducida (FEVI) que han sufrido un infarto agudo de miocardio (IAM).
La función de un DAI en el entorno inmediatamente posterior a un IAM en pacientes con una FEVI ≤ 35-40% se ha explorado previamente en dos ensayos controlados aleatorios (DINAMIT e IRIS) .3, 4 En DINAMIT, hubo una tasa significativamente más baja de MSC en pacientes aleatorizados a DAI que sin DAI (4% vs.8%; p = 0,009), pero hubo una tasa significativamente más alta de muertes sin MSC en el grupo de DAI que en el grupo sin DAI (15% vs. 9%; p = 0,02). De manera similar, en IRIS, hubo una tasa significativamente más baja de MSC en pacientes asignados al azar a DAI que sin DAI (6% vs.13%; p = 0.049), pero hubo una tasa significativamente más alta de muertes sin MSC en el grupo de DAI que en el grupo sin DAI (15% frente a 9%; p = 0,001).
Aunque los DAI se asociaron con un menor riesgo de MSC en estos ensayos aleatorizados, esto se vio compensado por la asociación con un alto riesgo de eventos no SCD. Como resultado, las guías actuales de ACC / AHA / HRS recomiendan la implantación de un DAI para la prevención primaria de la ECF en esta población después de un período de 40 días de tratamiento médico dirigido por las guías (o un período de 90 días de tratamiento médico dirigido por las guías si la revascularización es necesaria). realizado) (Figura 1) .5
Figura 1: Prevención primaria de la ECF en pacientes con cardiopatía isquémica
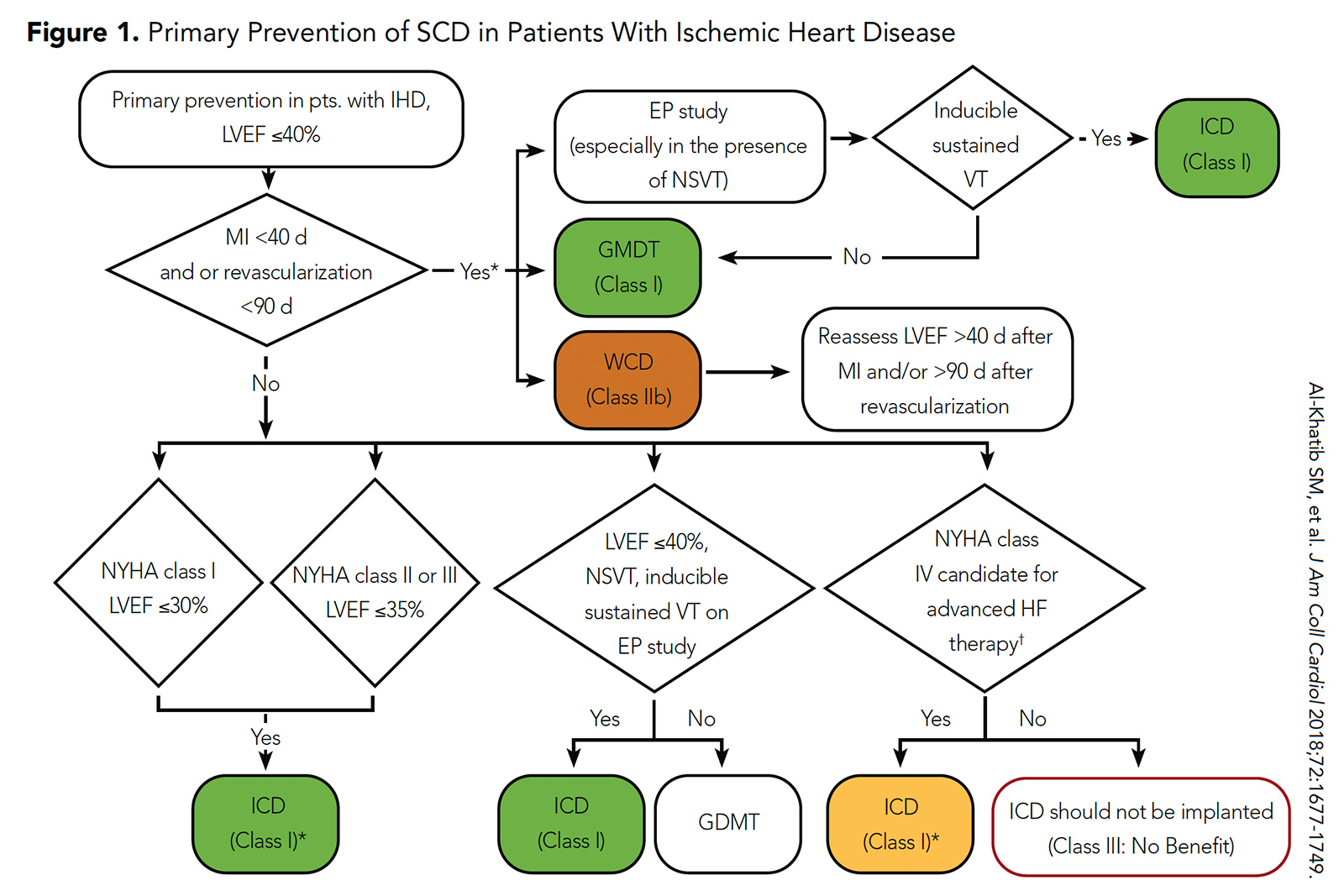 Haga clic en la imagen de arriba para ampliarla.
Haga clic en la imagen de arriba para ampliarla. Figura 2: Guía 2017 ACC / AHA / HRS para el uso de desfibrilador cardioversor portátil
 Haga clic en la imagen de arriba para ampliarla.
Haga clic en la imagen de arriba para ampliarla.
Sin embargo, el riesgo de MSC en el período inmediatamente posterior al IAM es mayor en los primeros 30 días. El ensayo VALIANT reclutó a 14.609 pacientes con una FEVI ≤ 40% después de un IAM y demostró que el 7% de los pacientes experimentaron muerte súbita o paro cardíaco durante un período de seguimiento de dos años. Un alarmante 19% de estas muertes ocurrió en los primeros 30 días después del IAM, y el riesgo fue mayor en pacientes con una FEVI ≤ 30% (2,3% por mes) .6
Tomados junto con los resultados de DINAMIT e IRIS, los resultados de VALIANT indicaron la necesidad de una estrategia sin DAI para proteger a los pacientes contra la aparición de ECF. El WCD, que ya estaba aprobado por la FDA en el momento de estos ensayos, parecía ser la solución perfecta.
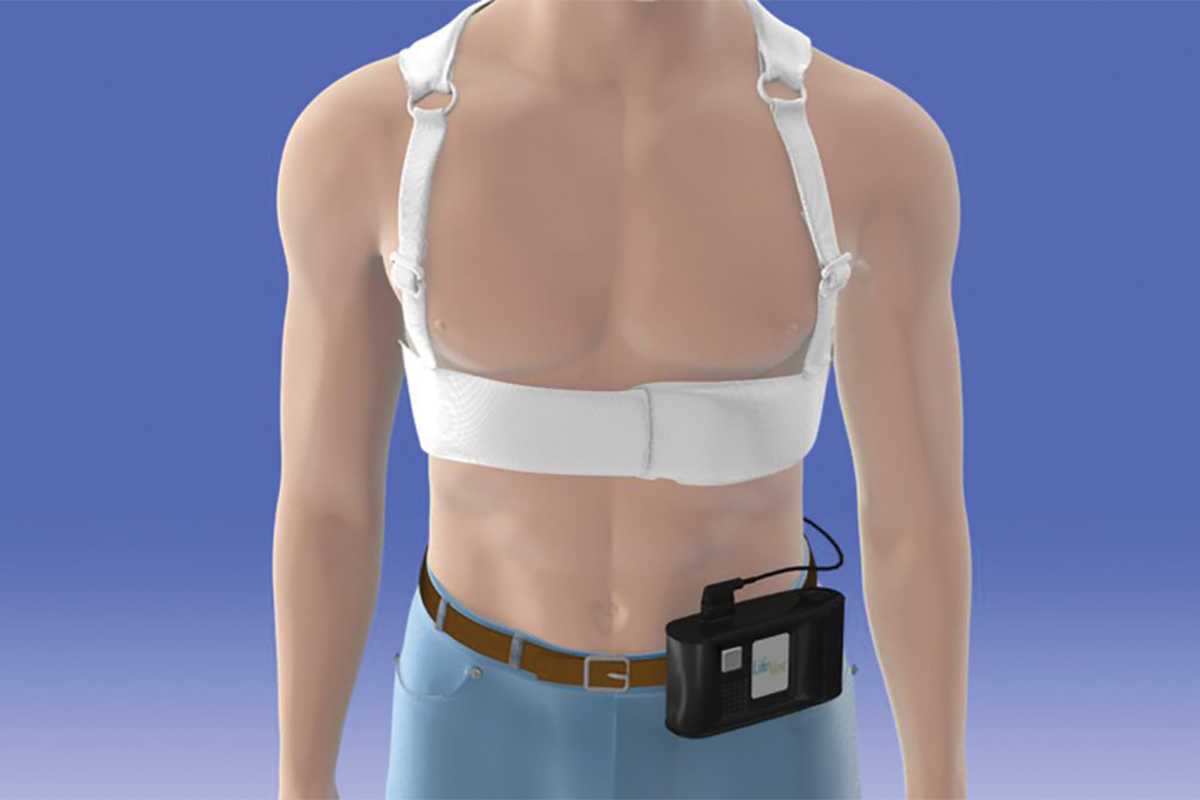
La versión actualmente disponible del WCD es el LifeVest de Zoll Medical Corporation.7 El dispositivo consta de un prenda para el pecho con dos almohadillas de desfibrilación colocadas verticalmente a lo largo de la espalda, un cinturón frontal que contiene una almohadilla de desfibrilador colocada horizontalmente con electrodos que detectan el ritmo cardíaco, y una pequeña caja de monitor que registra los ritmos y contiene la batería. Una vez activado, el LifeVest puede proporcionar al paciente tres posibles alarmas: una alerta de gong que indica que se requiere atención a la caja del monitor; una alerta de vibración que indica que se ha detectado una arritmia letal y que la secuencia de tratamiento de WCD se está activando; y una alerta de sirena que indica que una descarga es inminente. Inmediatamente antes de la administración de la descarga, se libera un gel azul de las tres almohadillas de desfibrilación sobre el paciente para mejorar el contacto para la conducción eléctrica. El vector impactante se encuentra entre las almohadillas del desfibrilador en la parte posterior y la almohadilla del desfibrilador en el cinturón frontal.
La experiencia del mundo real con el WCD se ha descrito en numerosos estudios publicados entre 2001 y 2018. Uno de los Las cohortes más grandes de pacientes estudiadas incluyeron 8.453 pacientes del registro Zoll. En total, 133 pacientes (1,6%) recibieron 309 descargas apropiadas y el 91% de las descargas lograron resucitar al paciente de una taquiarritmia ventricular (84% en pacientes no revascularizados y 95% en pacientes revascularizados). El tiempo medio desde el IAM hasta el choque fue de 16 días, y el 75% de los choques ocurrieron en el mes posterior al IAM.8
El autor principal presentó el tan esperado estudio VEST como un ensayo clínico de ruptura tardía. Jeffrey E. Olgin, MD, FACC, en ACC.18, y finalmente publicado en el New England Journal of Medicine.El objetivo del ensayo VEST fue determinar la eficacia de la WCD durante el período anterior a la indicación de los DAI en pacientes que han tenido un infarto de miocardio y tienen una FEVI reducida. Durante un período de inscripción de casi diez años, el ensayo asignó al azar a 2.302 pacientes con IAM y una FEVI ≤35% en una proporción de 2: 1 a WCD versus sin WCD. El análisis se realizó por intención de tratar.
Los resultados de VEST fueron notables porque no hubo diferencias significativas en el resultado compuesto primario de muerte súbita o muerte por taquicardia ventricular o fibrilación ventricular a los 90 días (arritmia muerte), que ocurrió en el 1,6% de los pacientes del grupo WCD y en el 2,4% de los pacientes del grupo sin WCD (riesgo relativo, 0,66; intervalo de confianza del 95%, 0,37-121; p = 0,18).
En particular, 43 pacientes (2,8%) en el grupo WCD nunca usaron un dispositivo y 20 pacientes (2,6%) en el grupo sin WCD recibieron el dispositivo fuera del estudio; 10 pacientes en el grupo WCD (0,7%) y 15 pacientes en el grupo sin WCD (1,5%) se perdieron durante el seguimiento, y dos pacientes en cada grupo (5% total) no tenían datos suficientes para determinar la causa de muerte. Los autores expresaron su preocupación de que la no adherencia al uso de la WCD en el grupo de WCD puede haber reducido la potencia del estudio, ya que el tiempo de uso esperado de la WCD del 70% solo se cumplió en las primeras dos semanas del ensayo. En última instancia, el ensayo VEST se consideró un estudio negativo de la capacidad de la WCD para reducir significativamente el riesgo de MSC en su población objetivo.2
Sin embargo, los resultados negativos no parecieron disuadir el uso de WCD y en cambio, animó a los investigadores a cuestionar sus hallazgos. El mayor metanálisis disponible de 28 estudios con 33 242 pacientes (incluido el brazo de intervención del ensayo VEST) de 2001 a 2018 reveló que los tratamientos apropiados de WCD, las descargas apropiadas de WCD y las descargas inapropiadas de WCD ocurrieron a una tasa de 7/100 personas , 5/100 personas y 2/100 personas, respectivamente, durante un período de tiempo de tres meses.
En este metanálisis, los pacientes con miocardiopatía isquémica, miocardiopatía no isquémica y miocardiopatía mixta experimentaron una WCD adecuada tratamientos a razón de 8/100 personas, 6/100 personas y 3/100 personas, respectivamente, durante un período de tres meses. En comparación con los pacientes con miocardiopatía isquémica en VEST, los pacientes con miocardiopatía isquémica en la cohorte sin VEST demostraron una incidencia más alta de terapia apropiada con WCD (11/100 personas frente a 1/100 personas durante tres meses). Al examinar el patrón de prescripción de WCD, los autores hicieron la interesante observación de que el uso continuo de WCD «probablemente sea impulsado por la finalidad de la SCD y en parte por el temor a un litigio, a pesar de la ausencia de datos que lo respalden». 9
El segundo de estos estudios examinó la mortalidad y los costos asociados con el uso de WCD en 16,935 pacientes a partir de datos de reclamos de Medicare. El uso de WCD se asoció con una reducción significativa de la mortalidad al año después del IAM (19,8% frente a 11,5%; p = 0,017), y esta reducción del 8,3% en la mortalidad absoluta correspondió a una relación costo-efectividad incremental (RCEI) de $ 12.373.11 En otras palabras, el uso del WCD cuesta $ 12,373 para salvar una vida en el primer año después de la AMI. De acuerdo con la Declaración de ACC / AHA sobre la metodología de costo / valor en las pautas de práctica clínica y las medidas de desempeño, la ICER para la WCD se clasificaría como un recurso de alto valor (ICER 12
Aunque el camino hacia la aceptación de la WCD ha Ha sido tortuoso, se ha ganado su lugar entre la lista corta de dispositivos médicos modernos que salvan vidas. En consecuencia, en la guía más reciente de 2017 ACC / AHA / HRS, el uso de una WCD después de un IAM en pacientes con una FEVI ≤35% recibió una recomendación IIb (Figura 2) .5
Como todas las terapias, la WCD es más efectiva cuando se usa según lo prescrito, pero esto requiere una adherencia continua por hasta 90 días, así como una atención constante hacia las diversas alarmas del dispositivo que pueden activarse en cualquier momento. Se están realizando desarrollos para mejorar las prendas, los monitores y la experiencia general del paciente, pero la adherencia probablemente limitará la población de pacientes que realmente se beneficiará de este dispositivo engorroso. Mientras tanto, seguirá funcionando t o el cardiólogo para decidir qué pacientes son los candidatos más apropiados no solo para recibir el LifeVest, sino también para usarlo.

Este artículo fue escrito por Edward Chu, MD, (@Ed_Chu_MD), becario de electrofisiología en entrenamiento (FIT) en Mount Sinai Medical Center en Nueva York.
- Feldman AM, Klein H, Tchou P, et al. Investigadores y coordinadores de WEARIT; Investigadores y coordinadores de BIROAD. Uso de un desfibrilador portátil en la terminación de taquiarritmias en pacientes con alto riesgo de muerte súbita: resultados del WEARIT / BIROAD. Pacing Clin Electrophysiol 2004; 27 (1): 4-9.
- Olgin JE, Pletcher MJ, Vittinghoff E, et al. Investigadores VEST. Desfibrilador automático portátil después de un infarto de miocardio.N Engl J Med 2018; 379: 1205-15.
- Hohnloser SH, Kuck KH, Dorian P, et al; Investigadores DINAMIT. Uso profiláctico de un desfibrilador automático implantable tras un infarto agudo de miocardio. N Engl J Med 2004; 351: 2481-8.
- Steinbeck G, Andresen D, Seidl K, et al; Investigadores de IRIS. Implantación de desfibrilador poco después de un infarto de miocardio. N Engl J Med 2009; 361: 1427-36.
- Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. Guía 2017 de la AHA / ACC / HRS para el tratamiento de pacientes con arritmias ventriculares y la prevención de la muerte cardíaca súbita: Resumen ejecutivo: Informe del Grupo de Trabajo del Colegio Estadounidense de Cardiología / Asociación Estadounidense del Corazón sobre guías de práctica clínica y la Sociedad del ritmo cardíaco. J Am Coll Cardiol 2018; 72: 1677-1749.
- Solomon SD, Zelenkofske S, McMurray JJ, et al. Valsartán en investigadores del ensayo de infarto agudo de miocardio (VALIANT). Muerte súbita en pacientes con infarto de miocardio y disfunción ventricular izquierda, insuficiencia cardíaca o ambos. N Engl J Med 2005; 352: 2581-8.
- Zoll LifeVest. Corporación Médica Zoll. Disponible aquí Acceso el 13 de septiembre de 2020.
- Epstein AE, Abraham WT, Bianco NR, et al. Uso de desfibrilador automático portátil en pacientes que se perciben como de alto riesgo después de un infarto de miocardio temprano. J Am Coll Cardiol 2013; 62: 2000-7.
- Masri A, Altibi AM, Erqou S, et al. Terapia con desfibrilador automático portátil para la prevención de la muerte cardíaca súbita: una revisión sistemática y un metanálisis. JACC Clin Electrophysiol 2019; 5: 152-61.
- Olgin JE, Lee BK, Vittinghoff E, et al. Impacto del cumplimiento del desfibrilador automático portátil en los resultados del ensayo VEST: análisis según el tratamiento y por protocolo. J Cardiovasc Electrophysiol 2020; 31: 1009-18.
- Clark MA, Szymkiewicz SJ, Volosin K. Mortalidad y costos asociados con los desfibriladores automáticos portátiles después de un infarto agudo de miocardio: un análisis de cohorte retrospectivo de los datos de reclamaciones de Medicare. J Innov Card Rhythm Manag 2019; 10: 3866-73.
- Anderson JL, Heidenreich PA, Barnett PG, et al; Grupo de trabajo de ACC / AHA sobre medidas de desempeño; Grupo de trabajo de ACC / AHA sobre directrices prácticas. Declaración de ACC / AHA sobre la metodología de costo / valor en las guías de práctica clínica y las medidas de desempeño: un informe del Grupo de Trabajo del Colegio Estadounidense de Cardiología / Asociación Estadounidense del Corazón sobre Medidas de Desempeño y Grupo de Trabajo sobre Guías de Práctica. J Am Coll Cardiol 2014; 63: 2304-22.
Temas clínicos: Arritmias y EP clínica, SCD / arritmias ventriculares
Palabras clave: Publicaciones de ACC, Revista de Cardiología, Administración de Alimentos y Medicamentos de los Estados Unidos, Aprobación de dispositivos, Fibrilación ventricular, Incidencia, Volumen sistólico, Riesgo, Intervalos de confianza, Medicare, Costo -Análisis de beneficios, vibración, estudios de seguimiento, metas, análisis de la intención de tratar, pérdida durante el seguimiento, estándar de atención
< Volver a los listados