9.9 Introducción a la síntesis orgánica
Objetivo
Después de completar esta sección, debería poder diseñar una síntesis de varios pasos para preparar un producto dado a partir de un material de partida dado, utilizando cualquiera de las reacciones introducidas en el libro de texto hasta este punto.
Notas de estudio
Debe He notado que algunos de los problemas asignados han requerido que se encadenen una serie de reacciones orgánicas para convertir un compuesto orgánico en otro cuando no hay una única reacción para lograr este objetivo. Esta cadena de reacciones se denomina «síntesis orgánica». Uno de los principales objetivos de este curso es ayudarlo a diseñar tales síntesis. Para lograr este objetivo, deberá tener todas las reacciones descritas en el curso disponibles en su memoria. Deberá recordar algunas reacciones con mucha más frecuencia. que otros, y la única manera de dominar este objetivo es practicar. Los ejemplos que se dan en este capítulo serán relativamente simples, pero pronto verá que puede diseñar algunas síntesis bastante sofisticadas utilizando un número limitado de reacciones básicas.
El estudio de la química orgánica expone al estudiante a una amplia gama de reacciones interrelacionadas. Los alquenos, por ejemplo, pueden convertirse en alcanos, alcoholes, haluros de alquilo, epóxidos, glicoles y boranos estructuralmente similares; aldehídos, cetonas y ácidos carboxílicos más pequeños; y agrandados por carbocatión y adiciones de radicales, así como por cicloadiciones. Todos estos productos pueden transformarse posteriormente en una serie de nuevos compuestos que incorporan una amplia variedad ty de grupos funcionales, y por lo tanto abierto a una mayor elaboracin. En consecuencia, la concepción lógica de una síntesis de varios pasos para la construcción de un compuesto designado a partir de un material de partida específico se convierte en uno de los problemas más desafiantes que pueden plantearse.
Una secuencia de reacciones simples de uno o dos pasos es no es tan difícil de deducir. Si, por ejemplo, se le pide a uno que prepare meso-3,4-hexanodiol a partir de 3-hexeno, la mayoría de los estudiantes se dan cuenta de que será necesario reducir el alquino a cis o trans-3-hexeno antes de emprender la formación de glicol. La hidroxilación de permanaganato o tetróxido de osmio de cis-3-hexeno formaría el meso isómero deseado. A partir del trans-3-hexeno, sería necesario epoxidar primero el alqueno con un perácido, seguido de la apertura del anillo con ion hidróxido. Este ejemplo ilustra una característica común en la síntesis: a menudo hay más de un procedimiento eficaz que conduce al producto deseado.
Las síntesis de varios pasos más largas requieren un análisis y una reflexión cuidadosos, ya que se deben considerar muchas opciones. Como un jugador de ajedrez experto que evalúa los pros y los contras de los movimientos potenciales a largo plazo, el químico debe evaluar el éxito potencial de varios caminos de reacción posibles, centrándose en el alcance y las limitaciones que restringen cada una de las reacciones individuales que se emplean. Esta puede ser una tarea desalentadora, la habilidad para la cual se adquiere con la experiencia y, a menudo, con prueba y error.
Los tres ejemplos que se muestran a continuación son ilustrativos. El primero es un simple problema de conversión de grupo funcional, que inicialmente puede parecer difícil. A menudo es útil trabajar estos problemas al revés, comenzando por el producto. En este caso, debería ser evidente que el ciclohexanol se puede sustituir por ciclohexanona, ya que esta última podría prepararse mediante una simple oxidación. Además, dado que el ciclohexano (y los alcanos en general) es relativamente poco reactivo, la bromación (o cloración) parecería ser un primer paso obvio. En este punto, se tiene la tentación de convertir el bromociclohexano en ciclohexanol mediante una reacción SN2 con ion hidróxido. Esta reacción indudablemente iría acompañada de la eliminación de E2, por lo que sería más limpio, aunque un paso más, hacer primero ciclohexeno y luego hidratarlo por cualquiera de varios métodos (por ejemplo, oximercuración e hidroboración), incluido el que se muestra al hacer clic en el diagrama
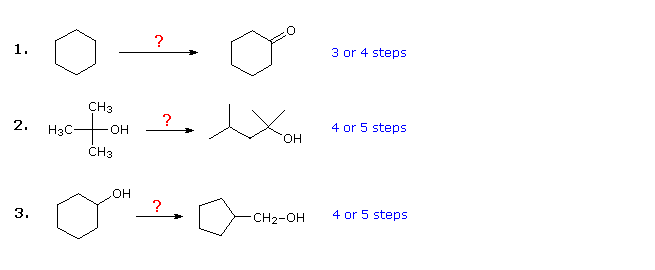 Respuesta
Respuesta
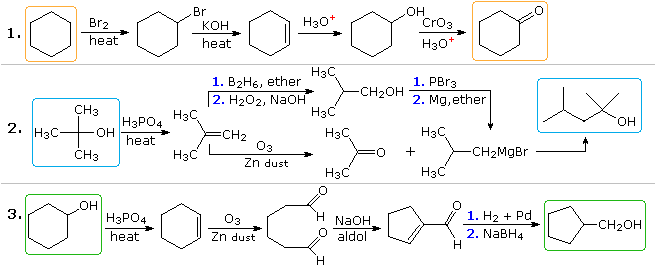
Las soluciones plausibles para el segundo y tercer problema también aparecerán arriba en este punto. En el problema 2, el producto deseado tiene siete átomos de carbono y el material de partida tiene cuatro. Claramente, se deben unir dos intermedios derivados del compuesto de partida y se debe perder un carbono, antes o después de que tenga lugar esta unión. La función de 3º-alcohol en el producto sugiere la formación por adición de Grignard a una cetona, y el isobuteno parece ser un buen precursor de cada uno de estos reactivos, como se muestra. El reactivo y los compuestos del producto en el tercer problema son isómeros, pero es claramente necesario algún tipo de secuencia de ruptura y formación de enlaces para que se produzca este cambio estructural. Un posible procedimiento se muestra arriba. También podría servir la transposición catalizada por ácido del óxido de ciclohexeno, seguida de reducción.
El método útil de elaborar síntesis partiendo de la molécula diana y trabajando hacia atrás hacia materiales de partida más simples ha sido formalizado por el profesor E. J. Corey (Harvard) y denominado análisis retrosintético. En este procedimiento, la molécula diana se transforma progresivamente en estructuras más simples desconectando enlaces carbono-carbono seleccionados. Estas desconexiones se basan en transformaciones, que son lo contrario de construcciones sintéticas plausibles. Cada estructura más simple, así generada, se convierte en el punto de partida para más desconexiones, lo que lleva a un conjunto ramificado de intermedios interrelacionados. Una transformación retrosintética se representa con el símbolo = >, como se muestra a continuación para los ejemplos anteriores 2 & 3. Una vez que se ha realizado un análisis completo , la síntesis deseada puede llevarse a cabo mediante la aplicación de las reacciones subyacentes a las transformaciones.
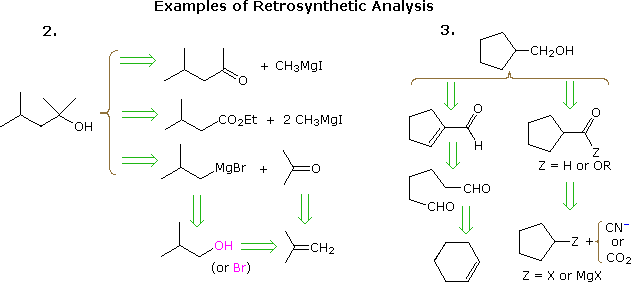
El diagrama anterior no proporciona un conjunto completo de transformaciones para estas transformaciones objetivo compuestos. Cuando se especifica un material de partida, como en los problemas anteriores, las vías propuestas deben reflejar esa restricción. Por tanto, las opciones de éster de 4-metil-2-pentanona y 3-metilbutirato del ejemplo 2, aunque son completamente razonables, no encajan bien con un comienzo de terc-butanol. Del mismo modo, un intermedio de ciclopentilo podría proporcionar una ruta excelente para el producto en el ejemplo 3, pero no cumple con las condiciones especificadas del problema.
El análisis retrosintético es especialmente útil cuando se consideran moléculas relativamente complejas sin restricciones de material de partida. Si se lleva a cabo sin prejuicios, a veces aparecen posibilidades inusuales e intrigantes. Desafortunadamente, la complejidad molecular (compuesta de tamaño, funcionalidad, incorporación de heteroátomos, conectividad cíclica y estereoisomería) generalmente conduce a árboles de transformación muy grandes y ampliamente ramificados. El análisis asistido por computadora ha demostrado ser útil, pero al final, los instintos y la experiencia del químico juegan un papel fundamental para llegar a un plan sintético exitoso. A continuación se proporcionan algunos ejemplos relativamente simples, la mayoría con restricciones de material de partida.
Ejercicios
Preguntas
Q9.9.1
Comenzando en 3-hexino predecir rutas sintéticas para lograr:
A – cis-3-hexeno
B – 3,4-dibromohexano
C – 3-hexanol
Q9.9.2
Comenzando con acetileno y cualquier haluro de alquilo proponga una síntesis para hacer (a) pentanal y (b) hexano.
Soluciones
S9.9.1

S9.9.2
.png?revision=1)
Colaboradores y atribuciones
-
Dr. Dietmar Kennepohl FCIC (Profesor de Química, Universidad de Athabasca)
-
Prof. Steven Farmer (Universidad Estatal de Sonoma)
-
William Reusch, Profesor Emérito (Universidad Estatal de Michigan), Libro de texto virtual de química orgánica