12.2: Relaciones molares
Relaciones molares
Los problemas de estequiometría se pueden caracterizar por dos cosas: (1) la información proporcionada en el problema, y (2) la información que se va a resolver, denominada desconocida. Lo dado y lo desconocido pueden ser reactivos, ambos productos, o uno puede ser un reactivo mientras que el otro es un producto. Las cantidades de las sustancias se pueden expresar en moles. Sin embargo, en una situación de laboratorio, es común determinar la cantidad de una sustancia encontrando su masa en gramos. La cantidad de una sustancia gaseosa puede expresarse por su volumen. En este concepto, nos centraremos en el tipo de problema en el que tanto las cantidades dadas como las desconocidas se expresan en moles.

Las ecuaciones químicas expresan las cantidades de reactivos y productos en a reactivos y productos en una reacción. Los coeficientes de una ecuación balanceada pueden representar el número de moléculas o el número de moles de cada sustancia. La producción de amoníaco \ (\ left (\ ce {NH_3} \ right) \) a partir de gases de nitrógeno e hidrógeno es una importante reacción industrial llamada proceso Haber, en honor al químico alemán Fritz Haber.
\
La ecuación balanceada se puede analizar de varias formas, como se muestra en la figura siguiente.
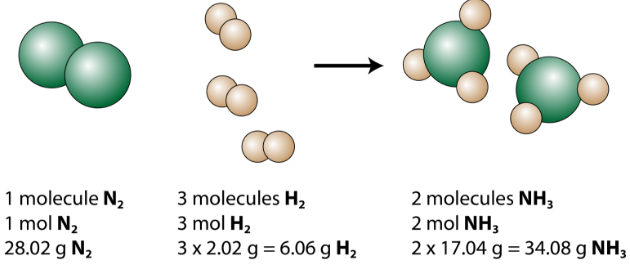
Vemos que 1 molécula de nitrógeno reacciona con 3 moléculas de hidrógeno para formar 2 moléculas de amoníaco. Ésta es la menor cantidad relativa posible de reactivos y productos. Para considerar cantidades relativas mayores, cada coeficiente se puede multiplicar por el mismo número. Por ejemplo, 10 moléculas de nitrógeno reaccionarían con 30 moléculas de hidrógeno para producir 20 moléculas de amoníaco.
La cantidad más útil para contar partículas es el mol. Entonces, si cada coeficiente se multiplica por un mol, la ecuación química balanceada nos dice que 1 mol de nitrógeno reacciona con 3 moles de hidrógeno para producir 2 moles de amoníaco. Esta es la forma convencional de interpretar cualquier ecuación química balanceada.
\
La masa y el número de átomos deben conservarse en cualquier reacción química. La cantidad de moléculas no se conserva necesariamente.

Una relación molar es un factor de conversión que relaciona las cantidades en moles de dos sustancias cualesquiera en una reacción química. Los números en un factor de conversión provienen de los coeficientes de la ecuación química balanceada. Las siguientes seis relaciones molares se pueden escribir para la reacción de formación de amoníaco anterior.
En un problema de relación molar, la sustancia dada, expresada en moles, se escribe primero. El factor de conversión apropiado se elige para convertir de moles de la sustancia dada a moles de la desconocida.