9.9 En introduktion till organisk syntes
Mål
Efter att ha avslutat detta avsnitt bör du kunna designa en flerstegssyntes att förbereda en viss produkt från ett givet utgångsmaterial med hjälp av någon av de reaktioner som introducerats i läroboken fram till denna punkt.
Studienoter
Du bör har märkt att några av de tilldelade problemen har krävt att du stränger samman ett antal organiska reaktioner för att omvandla en organisk förening till en annan när det inte finns någon enda reaktion för att uppnå detta mål. En sådan rad av reaktioner kallas en ”organisk syntes.” Ett av de viktigaste målen med denna kurs är att hjälpa dig att utforma sådana synteser. För att uppnå detta måste du ha alla de reaktioner som beskrivs i kursen tillgängliga i ditt minne. Du måste komma ihåg vissa reaktioner mycket oftare än andra, och det enda sättet att behärska detta mål är att öva. Exemplen i detta kapitel kommer att vara relativt enkla, men du kommer snart att se att du kan skapa några ganska sofistikerade synteser med ett begränsat antal grundläggande reaktioner.
Studien av organisk kemi utsätter en student för ett brett spektrum av sammanhängande reaktioner. Alkener kan till exempel omvandlas till strukturellt liknande alkaner, alkoholer, alkylhalogenider, epoxider, glykoler och boraner; klyftas till mindre aldehyder, ketoner och karboxylsyror, och förstoras genom karbokation och radikal tillsatser samt cykloadditions. Alla dessa produkter kan därefter omvandlas till en mängd nya föreningar som innehåller en stor variation funktionella grupper, och därmed öppna för ytterligare vidareutveckling. Följaktligen blir den logiska uppfattningen av en flerstegssyntes för konstruktion av en utsedd förening från ett specificerat utgångsmaterial ett av de mest utmanande problemen som kan uppstå.
En sekvens med ett eller två steg av enkla reaktioner är inte så svårt att härleda. Om man till exempel uppmanas att bereda meso-3,4-hexandiol från 3-hexyn, inser de flesta studenter att det kommer att vara nödvändigt att reducera alkynen till cis eller trans-3-hexen innan glykolbildningen påbörjas. Permanaganat eller osmiumtetroxidhydroxylering av cis-3-hexen skulle bilda den önskade meso-isomeren. Från trans-3-hexen skulle det vara nödvändigt att först epoxidisera alkenen med en persyra, följt av ringöppning med hydroxidjon. Detta exempel illustrerar ett vanligt inslag i syntes: det finns ofta mer än ett effektivt förfarande som leder till den önskade produkten.
Längre flerstegssyntes kräver noggrann analys och tanke, eftersom många alternativ måste övervägas. Liksom en expertschackspelare som utvärderar de långa räckvidden för och nackdelar med potentiella drag, måste kemisten bedöma den potentiella framgången för olika möjliga reaktionsvägar, med fokus på omfattningen och begränsningarna som begränsar var och en av de enskilda reaktionerna som används. Detta kan vara en skrämmande uppgift, vars skicklighet förvärvas av erfarenhet och ofta försök och fel.
De tre exemplen nedan är illustrativa. Den första är ett enkelt funktionellt gruppkonverteringsproblem, som initialt kan verka svårt. Det är ofta bra att arbeta sådana problem bakåt, från och med produkten. I detta fall bör det vara uppenbart att cyklohexanol kan ersätta cyklohexanon, eftersom den senare sedan kan framställas genom en enkel oxidation. Eftersom cyklohexan (och alkaner i allmänhet) är relativt oreaktivt, verkar bromering (eller klorering) också vara ett uppenbart första steg. Vid denna tidpunkt är man frestad att omvandla bromcyklohexan till cyklohexanol genom en SN2-reaktion med hydroxidjon. Denna reaktion skulle utan tvekan åtföljas av E2-eliminering, så det skulle vara renare, även om det är ett steg längre, att först göra cyklohexen och sedan hydrera den med någon av flera metoder (t.ex. oximärkning och hydroboration) inklusive den som visas genom att klicka på diagrammet
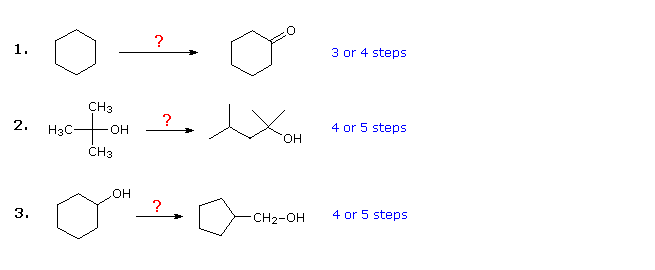 Svar
Svar
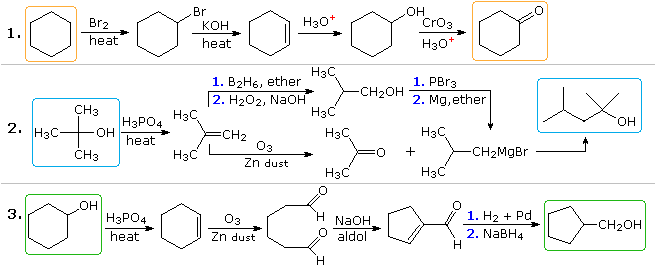
Plausibla lösningar för det andra och tredje problemet kommer också att visas ovan vid denna punkt. I problem 2 har den önskade produkten sju kolatomer och utgångsmaterialet har fyra. Det är uppenbart att två mellanprodukter härledda från utgångsföreningen måste sammanfogas, och ett kol måste gå förlorat, antingen före eller efter att denna bindning äger rum. 3 ° -alkoholfunktionen i produkten antyder bildning av en Grignard-tillsats till en keton, och isobuten verkar vara en bra föregångare till var och en av dessa reaktanter, såsom visas. Reaktanten och produktföreningarna i det tredje problemet är isomerer, men någon form av bindningsbrytande och bindningsskapande sekvens är uppenbarligen nödvändig för att denna strukturella förändring ska ske. En möjlig procedur visas ovan. Syrakatalyserad omläggning av cyklohexenoxid följt av reduktion kan också tjäna.
Det användbara tillvägagångssättet för att träna synteser som börjar från målmolekylen och arbeta bakåt mot enklare utgångsmaterial har formaliserats av professor E.J. Corey (Harvard) och kallas retrosyntetisk analys. I denna procedur omvandlas målmolekylen successivt till enklare strukturer genom att koppla bort utvalda kol-kolbindningar. Dessa frånkopplingar vilar på transformationer, som är motsatsen till troliga syntetiska konstruktioner. Varje enklare struktur, så genererad, blir utgångspunkten för ytterligare frånkopplingar, vilket leder till en grenad uppsättning av sammanhängande mellanprodukter. En retrosyntetisk transformation avbildas av symbolen = >, som visas nedan för tidigare exempel 2 & 3. När en fullständig analys har genomförts kan den önskade syntesen genomföras genom applicering av reaktionerna som ligger bakom transformationerna.
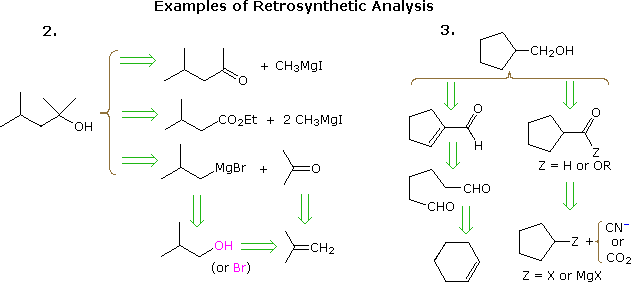
Diagrammet ovan tillhandahåller inte en komplett uppsättning transformationer för dessa mål föreningar. När ett utgångsmaterial specificeras, som i ovanstående problem, måste de föreslagna vägarna återspegla den begränsningen. Således passar 4-metyl-2-pentanon- och 3-metylbutyratester-alternativen i exempel 2, även om de är helt rimliga, inte bra med en tert-butanolstart. På samma sätt kan en cyklopentylmellanprodukt tillhandahålla en utmärkt väg till produkten i exempel 3 men uppfyller inte de specificerade villkoren för problemet.
Retrosyntetisk analys är särskilt användbar när man överväger relativt komplexa molekyler utan utgångsmaterialbegränsningar. Om det genomförs utan fördomar, uppträder ibland ovanliga och spännande möjligheter. Tyvärr leder molekylär komplexitet (sammansatt av storlek, funktionalitet, heteroatominkorporering, cyklisk anslutning och stereoisomerism) i allmänhet till mycket stora och omfattande grenade träd. Datorassisterad analys har visat sig vara till hjälp, men i slutändan spelar kemistens instinkter och erfarenhet en avgörande roll för att nå en framgångsrik syntetisk plan. Några relativt enkla exempel, de flesta med utgångsmaterialbegränsningar, ges nedan.
Övningar
Frågor
Q9.9.1
Börjar vid 3-hexyn förutsäger syntetiska vägar för att uppnå:
A – cis-3-hexen
B – 3,4-dibromohexan
C – 3-hexanol
Q9.9.2
Med utgångspunkt från acetylen och eventuella alkylhalogenider föreslås en syntes för att göra (a) pentanal och (b) hexan.
Lösningar
S9.9.1

S9.9.2
.png?revision=1)
Bidragsgivare och attribut
-
Dr. Dietmar Kennepohl FCIC (professor i kemi, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, professor emeritus (Michigan State U.), virtuell lärobok för organisk kemi