12.2: Molförhållanden
Molförhållanden
Stökiometriproblem kan kännetecknas av två saker: (1) informationen som ges i problemet, och (2) den information som ska lösas för, kallad okänd. Det givna och det okända kan båda vara reaktanter, båda vara produkter, eller den ena kan vara en reaktant medan den andra är en produkt. Mängderna av ämnena kan uttryckas i mol. I laboratoriesituationer är det dock vanligt att bestämma mängden av ett ämne genom att hitta dess massa i gram. Mängden av ett gasformigt ämne kan uttryckas genom dess volym. I detta koncept kommer vi att fokusera på den typ av problem där både de givna och de okända storheterna uttrycks i mol.

Kemiska ekvationer uttrycker mängderna av reaktanter och produkter i en reaktant och produkter i en reaktion. Koefficienterna för en balanserad ekvation kan antingen representera antalet molekyler eller antalet mol av varje substans. Produktionen av ammoniak \ (\ vänster (\ ce {NH_3} \ höger) \) från kväve- och vätgas är en viktig industriell reaktion som kallas Haber-processen, efter den tyska kemisten Fritz Haber.
\
Den balanserade ekvationen kan analyseras på flera sätt, som visas i figuren nedan.
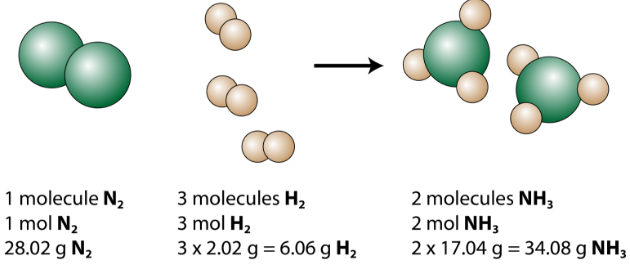
Vi ser att en molekyl kväve reagerar med 3 molekyler väte för att bilda 2 ammoniakmolekyler. Detta är de minsta möjliga relativa mängderna av reaktanterna och produkterna. För att beakta större relativa belopp kan varje koefficient multipliceras med samma antal. Till exempel skulle 10 molekyler kväve reagera med 30 molekyler väte för att producera 20 ammoniakmolekyler.
Den mest användbara mängden för att räkna partiklar är molen. Så om varje koefficient multipliceras med en mol, berättar den balanserade kemiska ekvationen att 1 mol kväve reagerar med 3 mol väte för att producera 2 mol ammoniak. Detta är det konventionella sättet att tolka en balanserad kemisk ekvation.
\
Massa och antalet atomer måste bevaras vid varje kemisk reaktion. Antalet molekyler sparas inte nödvändigtvis.

Ett molförhållande är en omvandlingsfaktor som relaterar mängderna i mol av två ämnen i en kemisk reaktion. Siffrorna i en omvandlingsfaktor kommer från koefficienterna för den balanserade kemiska ekvationen. Följande sex molförhållanden kan skrivas för den ammoniakbildande reaktionen ovan.
I ett molförhållande-problem skrivs den givna substansen, uttryckt i mol, först. Lämplig omvandlingsfaktor väljs för att konvertera från mol av den givna substansen till mol av det okända.