Frontiere în neuroștiința umană
Introducere
Conștiința este o excitare și conștientizare a mediului și a sinelui, care se realizează prin acțiunea sistemului de activare reticulară ascendentă (ARAS) pe tulpina creierului și cortexul cerebral (Daube, 1986; Paus, 2000; Zeman, 2001; Gosseries și colab., 2011). ARAS este compus din mai multe circuite neuronale care leagă trunchiul cerebral de cortex. Aceste conexiuni neuronale își au originea în principal în formarea reticulară (RF) a trunchiului cerebral și se proiectează prin relee sinaptice în nucleul intralaminar al talamusului către cortexul cerebral (Daube, 1986; Paus, 2000; Zeman, 2001; Afifi și Bergman, 2005; Gosseries și colab., 2011). În plus, mai multe nuclee ale trunchiului cerebral (locus coeruleus, rafe dorsală, rafe mediană, nucleu pedunculopontin, nucleu parabrahial), nuclei talamici nespecifici, hipotalamus și creierul bazal sunt, de asemenea, incluse în sistemul ARAS (Aston-Jones și colab., 2001 ; Parvizi și Damasio, 2003; Fuller și colab., 2011). Evaluarea amănunțită a ARAS este importantă pentru diagnosticarea și gestionarea pacienților cu tulburări de conștiență, cum ar fi pacienții aflați într-o stare vegetativă sau cei cu conștiință minimă (Zeman, 2001; Gosseries și colab., 2011).
RMN convențional al creierului, tehnici funcționale de neuroimagistică, metode electrofiziologice și spectroscopie MR au fost utilizate în studiile ARAS în creierul uman (Parvizi și Damasio, 2003; Schiff, 2006; Tshibanda și colab., 2009, 2010; Gawryluk și colab. ., 2010). Cu toate acestea, deoarece ARAS nu poate fi clar discriminat de structurile neuronale adiacente, identificarea și estimarea corectă a ARAS în creierul uman pot fi problematice atunci când se utilizează aceste metode. În contrast, imagistica prin tensiune prin difuzie (DTI) permite evaluarea substanței albe datorită capacității sale de a imagina caracteristicile de difuzie a apei (Mori și colab., 1999). În substanța albă normală, moleculele de apă au o libertate relativă de mișcare paralelă cu tractul fibrelor nervoase. Cu toate acestea, mișcările lor sunt restricționate pe tracturi, dând naștere la anizotropie de difuzie a substanței albe. În consecință, anizotropia de difuzie a fost utilizată pentru evaluarea gradului de schimbare a fibrelor în substanța albă (Chang și colab., 2010; Puig și colab., 2010). Mai multe studii recente au încercat să demonstreze utilitatea DTI pentru evaluarea leziunilor la pacienții cu tulburări de conștiență și conectivitate a nucleelor ARAS specifice din creierul uman (Voss și colab., 2006; Perlbarg și colab., 2009; Tollard și colab., 2009; Tshibanda și colab., 2009; Fernandez-Espejo și colab., 2010, 2011; Newcombe și colab., 2010; Edlow și colab., 2012). Cu toate acestea, se știe puțin despre întreaga reconstrucție și estimarea ARAS în creierul uman (Edlow și colab., 2012).
În studiul actual, folosind DTI, am încercat să reconstituim componenta unică inferioară ARAS de la RF pontină la nucleele intralaminar ale talamusului din creierul uman normal.
Materiale și metode
Subiecți
Douăzeci și șase de subiecți sănătoși normali (14 bărbați, 12 femei; vârsta medie, 31,85 ± 9,80 ani; interval, 20-50) fără istoric de boală neurologică au fost recrutați pentru acest studiu. Toți subiecții au participat la acest studiu ca voluntari și au acordat acordul scris înainte de a fi supuși scanării DTI. Studiul a fost aprobat de către comisia de revizuire instituțională a spitalului nostru.
Imagine tensor difuzivă
Datele DTI au fost achiziționate folosind o bobină cu 6 canale pe un Philips Gyroscan Intera 1.5-T ( Philips, Best, Olanda) cu imagini ecoplanare cu o singură fotografie. Pentru fiecare dintre cei 32 de gradienți de sensibilizare non-coliniară de difuzie, am achiziționat 67 de felii contigue paralele cu linia de comisură anterioară-comisură posterioară. Parametrii de imagistică au fost după cum urmează: matrice de achiziție = 96 × 96, reconstituită la matrice = 128 × 128, câmp vizual = 221 mm × 221 mm, TR = 10.726 ms, TE = 76 ms, factor de reducere a imaginii paralele (factor SENSE) = 2, factorul EPI = 49 și b = 1000 s / mm2, NEX = 1 și o grosime a feliei de 2,3 mm (dimensiunea voxelului izotrop dobândit 2,3 mm × 2,3 mm × 2,3 mm).
Fibra probabilistică Urmărirea
Analiza datelor imagistice ponderate prin difuzie a fost efectuată utilizând Biblioteca de software Oxford Center for Functional Magnetic Resonance Imaging of the Brain (FMRIB) Software Library (FSL; www.fmrib.ox.ac.uk/fsl). Înregistrarea bidimensională pe scări multiple afine a fost utilizată pentru corectarea efectului mișcării capului și a distorsiunii imaginii datorate curentului turbionar. Urmărirea fibrelor a fost efectuată utilizând o metodă probabilistică de tractografie bazată pe un model multifibre și aplicată în studiul curent utilizând rutine de tractografie implementate în difuzia FMRIB (5000 de probe simplificate, lungimi de trepte de 0,5 mm, praguri de curbură = 0,2) (Smith et al., 2004 ).Avantajele tractografiei probabilistice, care a fost utilizată în acest studiu, includ o rezistență mai mare la zgomot, precum și capacitatea de a detecta căi cu unghiuri mai clare și de a distinge fibrele de încrucișare (Behrens și colab., 2007; Winston și colab., 2011).
Calea ARAS a fost determinată de selecția fibrelor care trec prin regiunile semințe de interes (ROI) și ROI țintă (de terminare). Un ROI de sămânță a fost plasat pe RF al ponsului la nivelul zonei de intrare a nervului trigemen (Daube, 1986; Afifi și Bergman, 2005). Analiza lemniscului medial și a tractului rubrospinal a fost efectuată pentru a confirma limita RF pe pons (Figura 1A). Pentru analiza lemniscului medial, ROI de semințe au fost plasate pe medulla anteromedială și ROI țintă a fost plasat pe cortexul somatosenzorial (Hong și colab., 2010). Pentru analiza tractului rubrospinal, ROI semințe au fost plasate pe nucleul roșu și ROI țintă a fost plasat pe regiunea dorsolaterală contralaterală a medulei (zona Monakow) (Nathan și Smith, 1982; Kwon și colab., 2011). ROI țintă a fost dat pe nucleele intralaminare ale talamusului la nivelul planului comisural (Morel, 2007). În definirea nucleelor intralaminare ale talamusului, ne-am referit la un atlas cerebral (Morel, 2007) (Figura 1A). Din 5000 de probe generate din voxelul de semințe, rezultatele pentru contact au fost vizualizate la un prag minim de 1 simplificat prin fiecare voxel pentru analiză. Au fost măsurate valorile anizotropiei fracționate (FA), ale difuzivității medii (MD) și ale numărului de tracturi ale componentei unice inferioare a ARAS.
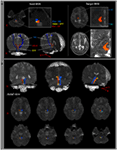
Figura 1. (A) Regiunile de semințe de interes (ROI) sunt date pe formațiunea reticulară pontină (culoare roșie). ROI țintă este dat pe nucleele intralaminare ale talamusului la nivelul planului comisural. Limita nucleului intralaminar al talamusului a fost definită prin referire la manualul atlasului cerebral (Morel, 2007). ML, lemnisc medial; RST, tractul rubrospinal; RF, formare reticulară; AC, comisură anterioară; PC, comisură posterioară. (B) Căile sistemului de activare reticular ascendent reconstituit sunt prezentate la fiecare nivel al creierului la un subiect normal (bărbat în vârstă de 26 de ani).
Analiza statistică
Software-ul SPSS (v.15.0; SPSS, Chicago, IL, SUA) a fost utilizat pentru analiza datelor. Testul t asociat a fost utilizat pentru determinarea diferenței de valori a parametrilor DTI ai ARAS între emisferele dreapta și stânga. Testul de corelație Pearson a fost utilizat pentru determinarea corelației dintre parametrii DTI ai ARAS și vârstă. Rezultatele au fost considerate semnificative atunci când valoarea p a fost < 0.05.
Rezultate
Am reconstituit componenta unică inferioară a ARAS dintre pontină RF și nuclei intralaminari ai talamusului. Componenta reconstituită a ARAS a provenit din RF pontină, a urcat prin tegmentul mezencefalic imediat posterior nucleului roșu și apoi s-a terminat pe nucleii intralaminari ai talamusului la nivelul planului comisural la toți subiecții (Figura 1B).
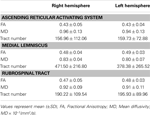
Tabelul 1. Parametrii de imagine a tensorului de difuzie al sistemului de activare reticular ascendent .
Discuție
În studiul actual, folosind DTI, am reconstituit una dintre căile principale ale ARAS, componenta unică inferioară a ARAS de la RF la talamus la subiecții normali, deși ARAS constă din nuclee suplimentare ale trunchiului cerebral, hipotalamus, creierul bazal și proiecții talamocorticale către cortexul cerebral. Am selectat două ROI pentru reconstrucția componentei unice inferioare a ARAS: ROI de semințe, care a fost RF al pons la nivelul zonei de intrare a nervului trigemen (Daube, 1986; Afifi și Bergman, 2005) și ținta ROI, care a inclus nucleele intralaminare ale talamusului (nucleii laterali centrali, nucleii centromedieni / parafasciculari și nucleii paracentrali) la nivelul planului comisural (Morel, 2007). Porțiunea rostrală a RF a trunchiului cerebral deasupra zonei de intrare a nervului trigemen este cunoscută sub numele de ARAS; în schimb, porțiunea caudală a RF este implicată în funcția motorie și funcția autonomă legată de funcția cardiacă și respiratorie (Daube, 1986). Prin urmare, am plasat ROI-ul semințelor în RF la nivelul zonei de intrare a nervului trigemen. Am plasat ROI țintă în nucleii intralaminar, care sunt nucleii principali ai ARAS printre nucleii talamici nespecifici. Prin urmare, credem că, deoarece nu am putut include și ceilalți nuclei talamici preocupați de ARAS, componenta unică inferioară a ARAS care a fost reconstruită în studiul actual nu este întreaga componentă inferioară unică a ARAS, ci partea principală a întreaga componentă unică inferioară a ARAS.În consecință, componenta unică inferioară a ARAS a provenit din RF pontină, a urcat prin tegmentul mezencefalic posterior nucleului roșu și apoi s-a terminat pe nucleii intralaminari ai talamusului. În plus, valorile pentru FA, MD și numere de tract ale componentei unice inferioare reconstruite a ARAS nu au diferit semnificativ între emisferele dreapta și stânga. Numărul tractului este determinat de numărul de voxeli conținuți într-un tract neuronal (Kwak și colab., 2010). Valoarea FA indică gradul de direcționalitate și integritate a microstructurilor de substanță albă, cum ar fi axonii, mielina și microtubulii, iar valoarea ADC indică magnitudinea difuziei apei (Assaf și Pasternak, 2008).
Mai multe studii au demonstrat utilitatea clinică a DTI prin estimarea unor zone ale componentei unice inferioare a ARAS de la RF la talamus la pacienții cu tulburări de conștiență (Perlbarg și colab., 2009; Tollard și colab., 2009; Newcombe și colab., 2010; Fernandez-Espejo și colab., 2011). Tollard și colab. (2009) au raportat despre utilitatea DTI, care a fost efectuată în stadiul subacut pentru predicția rezultatului la 45 de pacienți cu TBI severă (traumatism cerebral traumatic) (absența răspunsului la ordinele simple). În studiul lor, au măsurat valoarea FA în mai multe zone supratentoriale și infratentoriale, inclusiv ponsul anterior, ponsul posterior și creierul mediu și au demonstrat că scăderea FA infratentorială și supratentorială, cu excepția ponsului posterior, a permis predicția rezultatelor nefavorabile. 1 an de la TBI. Perlbarg și colab. (2009), care au efectuat scanare DTI la 30 de pacienți cu absența răspunsului la ordinele simple după TBI severă, au raportat o scădere definitivă a FA măsurată în fasciculul longitudinal inferior, creierul mediu (pedunculul cerebral și tegmentul), membrul posterior al capsulei interne , și corpul calos posterior în grupul de rezultate nefavorabile. Newcombe și colab. (2010) au folosit DTI pentru caracterizarea extinderii și localizării pierderii substanței albe la pacienții care se aflau într-o stare vegetativă secundară TBI (șapte pacienți) și la pacienții cu leziuni ischemico-hipoxice (cinci pacienți). Anomaliile din zonele supratentoriale au fost observate la ambele grupuri; în schimb, anomaliile trunchiului cerebral au fost observate numai în grupul TBI. Fernandez-Espejo și colab. (2011) au folosit DTI în diferențierea neuropatologiei a 25 de pacienți vegetativi și minim conștienți. Au ajuns la concluzia că pacienții cu conștiență minimă și cei aflați într-o stare vegetativă diferă în materie albă subcorticală și în regiunile talamice, dar nu par să difere în trunchiul cerebral. Într-un studiu recent care utilizează imagistica cu difuzie cu rezoluție unghiulară ridicată, Edlow și colab. (2012) au raportat despre conectivitatea neuroanatomică a ARAS în creierul uman, atât in vivo, cât și ex vivo. Au demonstrat că conectivitățile nucleelor ARAS specifice au fost implicate în excitare, iar cele ale nucleilor talamici au fost implicate în modularea excitării.
În concluzie, folosind DTI, am reconstituit componenta unică inferioară a ARAS din RF către talamusul din creierul uman. Credem că metodologia utilizată și rezultatele acestui studiu pot fi utile cercetătorilor care studiază ARAS în creierul uman. Cu toate acestea, una dintre limitările acestui studiu este că nu am reușit să elucidăm pe deplin întregul sistem ARAS, deoarece nu am inclus în analiză alte nuclee talamice și de trunchi cerebral care sunt, de asemenea, implicate în ARAS. Sunt necesare studii suplimentare privind utilitatea clinică a descoperirilor noastre, precum și studii privind proiecțiile ARAS de la talamus la cortexul cerebral.
Declarația privind conflictul de interese
Autorii declară că cercetarea a fost realizată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
Mulțumiri
Această activitate a fost susținută de DGIST R & Programul D al Ministerului Educației, Științei și Tehnologiei din Coreea (13-BD-0401).
Afifi, AK și Bergman, RA (2005). Neuroanatomie funcțională: text și atlas. New York: Lange Medical Books / McGraw-Hill.
Morel, A. (2007). Atlas stereotactic al talamului uman și al ganglionilor bazali. New York: Informa Healthcare.