12.2: Mole Ratios
Mole Ratios
Problemele de stoichiometrie pot fi caracterizate prin două lucruri: (1) informațiile date în problemă și (2) informațiile care trebuie rezolvate, denumite necunoscute. Date și necunoscute pot fi ambele reactive, ambele pot fi produse sau unul poate fi un reactant în timp ce celălalt este un produs. Cantitățile de substanțe pot fi exprimate în alunițe. Cu toate acestea, într-o situație de laborator, este obișnuit să se determine cantitatea unei substanțe prin găsirea masei acesteia în grame. Cantitatea de substanță gazoasă poate fi exprimată prin volumul acesteia. În acest concept, ne vom concentra asupra tipului de problemă în care atât cantitățile date, cât și cantitățile necunoscute sunt exprimate în moli.

Ecuațiile chimice exprimă cantitățile de reactanți și produse din a reactanți și produse într-o reacție. Coeficienții unei ecuații echilibrate pot reprezenta fie numărul de molecule, fie numărul de moli din fiecare substanță. Producția de amoniac \ (\ left (\ ce {NH_3} \ right) \) din azot și hidrogen este o reacție industrială importantă numită procesul Haber, după chimistul german Fritz Haber.
\
Ecuația echilibrată poate fi analizată în mai multe moduri, așa cum se arată în figura de mai jos.
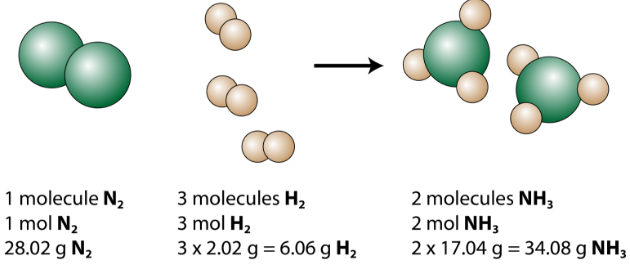
Vedem că o moleculă de azot reacționează cu 3 molecule de hidrogen pentru a forma 2 molecule de amoniac. Aceasta este cea mai mică cantitate relativă posibilă de reactanți și produse. Pentru a lua în considerare sume relative mai mari, fiecare coeficient poate fi înmulțit cu același număr. De exemplu, 10 molecule de azot ar reacționa cu 30 de molecule de hidrogen pentru a produce 20 de molecule de amoniac.
Cea mai utilă cantitate pentru numărarea particulelor este molul. Deci, dacă fiecare coeficient este înmulțit cu un mol, ecuația chimică echilibrată ne spune că 1 mol de azot reacționează cu 3 moli de hidrogen pentru a produce 2 moli de amoniac. Acesta este modul convențional de a interpreta orice ecuație chimică echilibrată.
\
Masa și numărul de atomi trebuie păstrate în orice reacție chimică. Numărul de molecule nu este neapărat conservat.

Un raport molar este un factor de conversie care raportează cantitățile în moli ale oricăror două substanțe într-o reacție chimică. Numerele dintr-un factor de conversie provin din coeficienții ecuației chimice echilibrate. Următoarele șase rapoarte molare pot fi scrise pentru reacția de formare a amoniacului de mai sus.
Într-o problemă a raportului molar, substanța dată, exprimată în moli, este scrisă mai întâi. Factorul de conversie adecvat este ales pentru a converti de la moli din substanța dată în moli de necunoscut.