Fronteiras na Neurociência Humana
Introdução
Consciência é uma excitação e consciência do ambiente e do eu, que é alcançada através da ação do sistema de ativação reticular ascendente (ARAS) em o tronco cerebral e o córtex cerebral (Daube, 1986; Paus, 2000; Zeman, 2001; Gosseries et al., 2011). O ARAS é composto por vários circuitos neuronais que conectam o tronco cerebral ao córtex. Essas conexões neuronais se originam principalmente na formação reticular (RF) do tronco encefálico e se projetam através de relés sinápticos no núcleo intralaminar do tálamo para o córtex cerebral (Daube, 1986; Paus, 2000; Zeman, 2001; Afifi e Bergman, 2005; Gosseries et al., 2011). Além disso, vários núcleos do tronco cerebral (locus coeruleus, rafe dorsal, rafe mediana, núcleo pedunculopontino, núcleo parabraquial), núcleos talâmicos inespecíficos, hipotálamo e prosencéfalo basal também estão incluídos no sistema ARAS (Aston-Jones et al., 2001 ; Parvizi e Damasio, 2003; Fuller et al., 2011). A avaliação completa do ARAS é importante para o diagnóstico e tratamento de pacientes com consciência prejudicada, como pacientes que estão em estado vegetativo ou com consciência mínima (Zeman, 2001; Gosseries et al., 2011).
MRI convencional do cérebro, técnicas de neuroimagem funcional, métodos eletrofisiológicos e espectroscopia de RM têm sido usados em estudos do ARAS no cérebro humano (Parvizi e Damasio, 2003; Schiff, 2006; Tshibanda et al., 2009, 2010; Gawryluk et al. ., 2010). No entanto, como o ARAS não pode ser claramente discriminado de estruturas neurais adjacentes, a identificação e estimativa precisas do ARAS no cérebro humano podem ser problemáticas ao usar esses métodos. Em contraste, a imagem por tensor de difusão (DTI) permite a avaliação da substância branca devido à sua capacidade de imagens das características de difusão na água (Mori et al., 1999). Na substância branca normal, as moléculas de água têm relativa liberdade de movimento paralelo aos tratos das fibras nervosas. No entanto, seus movimentos são restritos entre os tratos, dando origem à anisotropia de difusão da substância branca. Consequentemente, a anisotropia de difusão tem sido usada para avaliar a extensão da alteração da fibra na substância branca (Chang et al., 2010; Puig et al., 2010). Vários estudos recentes tentaram demonstrar a utilidade do DTI para avaliação de lesões em pacientes com consciência prejudicada e conectividade de núcleos ARAS específicos no cérebro humano (Voss et al., 2006; Perlbarg et al., 2009; Tollard et al., 2009; Tshibanda et al., 2009; Fernandez-Espejo et al., 2010, 2011; Newcombe et al., 2010; Edlow et al., 2012). No entanto, pouco se sabe sobre toda a reconstrução e estimativa do ARAS no cérebro humano (Edlow et al., 2012).
No estudo atual, usando DTI, tentamos reconstruir o componente único inferior do ARAS do RF pontino aos núcleos intralaminares do tálamo no cérebro humano normal.
Materiais e métodos
Sujeitos
Vinte e seis sujeitos saudáveis normais (14 homens, 12 mulheres; idade média, 31,85 ± 9,80 anos; faixa, 20-50) sem histórico de doença neurológica foram recrutados para este estudo. Todos os indivíduos participaram deste estudo como voluntários e forneceram consentimento por escrito antes de serem submetidos a varredura DTI. O estudo foi aprovado pelo conselho de revisão institucional de nosso hospital.
Imagem do tensor de difusão
Os dados de DTI foram adquiridos usando uma bobina de cabeça de 6 canais em um 1.5-T Philips Gyroscan Intera ( Philips, Best, Holanda) com imagem ecoplanar de disparo único. Para cada um dos 32 gradientes de sensibilização à difusão não colinear, adquirimos 67 cortes contíguos paralelos à linha comissura anterior-posterior. Os parâmetros de imagem foram os seguintes: matriz de aquisição = 96 × 96, reconstruída na matriz = 128 × 128, campo de visão = 221 mm × 221 mm, TR = 10.726 ms, TE = 76 ms, fator de redução de imagem paralela (fator de SENTIDO) = 2, fator de EPI = 49 e b = 1000 s / mm2, NEX = 1 e uma espessura de corte de 2,3 mm (tamanho do voxel isotrópico adquirido 2,3 mm × 2,3 mm × 2,3 mm).
Fibra probabilística Rastreamento
A análise de dados de imagem ponderados por difusão foi realizada usando a Biblioteca de Software Oxford Centre for Functional Magnetic Resonance of the Brain (FMRIB) (FSL; www.fmrib.ox.ac.uk/fsl). O registro bidimensional multi-escala afim foi usado para correção do efeito do movimento da cabeça e distorção da imagem devido à corrente parasita. O rastreamento de fibra foi realizado usando um método de tractografia probabilística baseado em um modelo multifibras e aplicado no estudo atual utilizando rotinas de tractografia implementadas em FMRIB Diffusion (5000 amostras aerodinâmicas, comprimentos de passo de 0,5 mm, limiares de curvatura = 0,2) (Smith et al., 2004 )As vantagens da tractografia probabilística, que foi utilizada neste estudo, incluem maior robustez ao ruído, bem como a capacidade de detectar caminhos com ângulos mais agudos e distinguir fibras cruzadas (Behrens et al., 2007; Winston et al., 2011).
O caminho do ARAS foi determinado pela seleção de fibras que passam pelas regiões de sementes de interesse (ROI) e ROIs alvo (terminação). Uma semente ROI foi colocada na RF da ponte ao nível da zona de entrada do nervo trigêmeo (Daube, 1986; Afifi e Bergman, 2005). A análise do lemnisco medial e do trato rubrospinal foi realizada para confirmar o limite do RF na ponte (Figura 1A). Para a análise do lemnisco medial, as ROIs de sementes foram colocadas na medula anteromedial e a ROI alvo foi colocada no córtex somatossensorial (Hong et al., 2010). Para análise do trato rubrospinal, sementes de ROIs foram colocadas no núcleo vermelho e a ROI alvo foi colocada na região dorsolateral contralateral da medula (área de Monakow) (Nathan e Smith, 1982; Kwon et al., 2011). A meta de ROI foi dada nos núcleos intralaminares do tálamo ao nível do plano comissural (Morel, 2007). Na definição dos núcleos intralaminares do tálamo, nos referimos a um atlas do cérebro (Morel, 2007) (Figura 1A). De 5.000 amostras geradas a partir do voxel de semente, os resultados de contato foram visualizados em um limite mínimo de 1 simplificado em cada voxel para análise. Valores de anisotropia fracionada (FA), difusividade média (MD) e número de trato do componente único inferior de ARAS foram medidos.
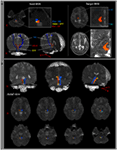
Figura 1. (A) As regiões de sementes de interesse (ROI) são fornecidas na formação reticular pontina (cor vermelha). A meta de ROI é dada nos núcleos intralaminares do tálamo ao nível do plano comissural. O limite dos núcleos intralaminares do tálamo foi definido por referência ao livro de texto do atlas do cérebro (Morel, 2007). ML, lemnisco medial; RST, trato rubrospinal; RF, formação reticular; AC, comissura anterior; PC, comissura posterior. (B) As vias do sistema de ativação reticular ascendente reconstruído são mostradas em cada nível do cérebro em um sujeito normal (homem de 26 anos).
Análise estatística
O software SPSS (v.15.0; SPSS, Chicago, IL, EUA) foi usado para a análise dos dados. O teste t pareado foi usado para determinar a diferença nos valores dos parâmetros de DTI da ARAS entre os hemisférios direito e esquerdo. O teste de correlação de Pearson foi usado para determinar a correlação entre os parâmetros de DTI da ARAS e a idade. Os resultados foram considerados significativos quando o valor de p era < 0,05.
Resultados
Nós reconstruímos o único componente inferior do ARAS entre os pontos RF e núcleos intralaminares do tálamo. O componente reconstruído do ARAS originou-se do RF pontino, ascendeu pelo tegmento mesencefálico logo posterior ao núcleo vermelho e, em seguida, terminou nos núcleos intralaminares do tálamo ao nível do plano comissural em todos os indivíduos (Figura 1B). / p>
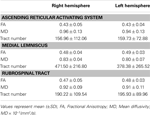
Tabela 1. Parâmetros de imagem do tensor de difusão do sistema de ativação reticular ascendente .
Discussão
No estudo atual, usando DTI, reconstruímos uma das principais vias de o ARAS, o único componente inferior do ARAS do RF ao tálamo em indivíduos normais, embora o ARAS consista em núcleos adicionais do tronco cerebral, hipotálamo, prosencéfalo basal e projeções tálamo-corticais para o córtex cerebral. Selecionamos duas ROIs para reconstrução do componente único inferior do ARAS: a ROI da semente, que era o RF da ponte ao nível da zona de entrada do nervo trigêmeo (Daube, 1986; Afifi e Bergman, 2005), e o alvo ROI, que incluía os núcleos intralaminares do tálamo (os núcleos laterais centrais, núcleos centromedianos / parafasciculares e núcleos paracentrais) ao nível do plano comissural (Morel, 2007). A porção rostral do RF do tronco cerebral acima da zona de entrada do nervo trigêmeo é conhecida como ARAS; em contraste, a porção caudal do RF está envolvida na função motora e na função autonômica relacionada à função cardíaca e respiratória (Daube, 1986). Portanto, colocamos a ROI da semente no RF ao nível da zona de entrada do nervo trigêmeo. Colocamos a ROI alvo nos núcleos intralaminares, que são os principais núcleos do ARAS entre os núcleos talâmicos não específicos. Portanto, acreditamos que, por não podermos incluir os outros núcleos talâmicos relacionados com o ARAS, o componente único inferior do ARAS que foi reconstruído no estudo atual não é todo o componente único inferior do ARAS, mas a parte principal do inteiro inferior único componente do ARAS.Conseqüentemente, o componente único inferior do ARAS originou-se do RF pontino, ascendeu através do tegmento mesencefálico posterior ao núcleo vermelho e então terminou nos núcleos intralaminares do tálamo. Além disso, os valores de FA, MD e números de trato do componente único inferior reconstruído da ARAS não diferiram significativamente entre os hemisférios direito e esquerdo. O número do trato é determinado pelo número de voxels contidos em um trato neural (Kwak et al., 2010). O valor FA indica o grau de direcionalidade e integridade das microestruturas da substância branca, como axônios, mielina e microtúbulos, e o valor ADC indica a magnitude da difusão de água (Assaf e Pasternak, 2008).
Vários estudos demonstraram a utilidade clínica do DTI estimando algumas áreas do componente único inferior do ARAS do FR ao tálamo em pacientes com comprometimento da consciência (Perlbarg et al., 2009; Tollard et al., 2009; Newcombe et al., 2010; Fernandez-Espejo et al., 2011). Tollard et al. (2009) relataram a utilidade do DTI, que foi realizado no estágio subagudo para predição de desfecho em 45 pacientes com TCE grave (lesão cerebral traumática) (ausência de resposta a ordens simples). Em seu estudo, eles mediram o valor de FA em várias áreas supratentorial e infratentorial, incluindo a ponte anterior, ponte posterior e mesencéfalo, e demonstraram que a diminuição da FA infratentorial e supratentorial, exceto na ponte posterior, permitiu a previsão de resultados desfavoráveis 1 ano de TBI. Perlbarg et al. (2009), que realizou varredura de DTI em 30 pacientes com ausência de resposta a ordens simples após TCE grave, relatou uma diminuição definitiva na AF medida no fascículo longitudinal inferior, mesencéfalo (pedúnculo cerebral e tegmento), membro posterior da cápsula interna , e corpo caloso posterior no grupo de desfecho desfavorável. Newcombe et al. (2010) utilizaram DTI para caracterizar a extensão e localização da perda de substância branca em pacientes que estavam em estado vegetativo secundário a TCE (sete pacientes) e pacientes com lesão isquêmico-hipóxica (cinco pacientes). Anormalidades nas áreas supratentorial foram observadas em ambos os grupos; em contraste, anormalidades do tronco cerebral foram observadas apenas no grupo TCE. Fernandez-Espejo et al. (2011) utilizaram DTI na diferenciação da neuropatologia de 25 pacientes vegetativos e minimamente conscientes. Eles concluíram que pacientes minimamente conscientes e aqueles em estado vegetativo diferiam na substância branca subcortical e nas regiões talâmicas, mas pareciam não diferir no tronco cerebral. Em um estudo recente usando imagem de difusão de alta resolução angular, Edlow et al. (2012) relataram a conectividade neuroanatômica do ARAS no cérebro humano, tanto in vivo quanto ex vivo. Eles demonstraram que as conectividades de núcleos ARAS específicos estavam implicadas na excitação, e aqueles dos núcleos talâmicos estavam implicados na modulação da excitação.
Em conclusão, usando DTI, reconstruímos o componente único inferior do ARAS a partir do RF para o tálamo no cérebro humano. Acreditamos que a metodologia utilizada e os resultados deste estudo podem ser úteis para os pesquisadores que estudam o ARAS no cérebro humano. No entanto, uma das limitações deste estudo é que não fomos capazes de elucidar totalmente todo o sistema ARAS porque não incluímos outros núcleos talâmicos e do tronco encefálico em nossa análise que também estão envolvidos no ARAS. São necessários mais estudos sobre a utilidade clínica de nossos achados, bem como estudos sobre as projeções do ARAS do tálamo para o córtex cerebral.
Declaração de conflito de interesses
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Este trabalho foi apoiado pelo DGIST R & Programa D do Ministério da Educação, Ciência e Tecnologia da Coreia (13-BD-0401).
Afifi, AK e Bergman, RA (2005). Neuroanatomia funcional: Texto e Atlas. Nova York: Lange Medical Books / McGraw-Hill.
Morel, A. (2007). Atlas Estereotático do Tálamo Humano e Gânglios Basais. Nova York: Informa Healthcare.