9.9 Uma introdução à síntese orgânica
Objetivo
Depois de concluir esta seção, você deverá ser capaz de projetar uma síntese em várias etapas para preparar um determinado produto a partir de um determinado material inicial, usando qualquer uma das reações introduzidas no livro-texto até este ponto.
Notas de estudo
Você deve perceberam que alguns dos problemas atribuídos exigiram que você agrupasse uma série de reações orgânicas para converter um composto orgânico em outro quando não houvesse uma única reação para atingir esse objetivo. Essa sequência de reações é chamada de “síntese orgânica”. Um dos principais objetivos deste curso é auxiliá-lo na elaboração de tais sínteses. Para atingir este objetivo, você precisará ter todas as reações descritas no curso disponíveis em sua memória. Você precisará lembrar algumas reações com muito mais frequência do que outros, e a única maneira de dominar esse objetivo é praticar. Os exemplos dados neste capítulo serão relativamente simples, mas você logo verá que pode criar algumas sínteses bastante sofisticadas usando um número limitado de reações básicas.
O estudo da química orgânica expõe o aluno a uma ampla gama de reações inter-relacionadas. Alcenos, por exemplo, podem ser convertidos em alcanos, álcoois, halogenetos de alquila, epóxidos, glicóis e boranos estruturalmente semelhantes; clivados em aldeídos, cetonas e ácidos carboxílicos menores; e aumentados por carbocátions e adições de radicais, bem como cicloadições. Todos esses produtos podem ser transformados subsequentemente em uma série de novos compostos que incorporam uma ampla variedade de grupos funcionais e, portanto, aberto a uma elaboração ainda Consequentemente, a concepção lógica de uma síntese de várias etapas para a construção de um composto designado a partir de um material de partida especificado torna-se um dos problemas mais desafiadores que podem ser colocados.
Uma sequência de uma ou duas etapas de reações simples é não é tão difícil de deduzir. Se, por exemplo, alguém é solicitado a preparar meso-3,4-hexanodiol a partir de 3-hexino, a maioria dos alunos percebe que será necessário reduzir o alcino a cis ou trans-3-hexeno antes de iniciar a formação de glicol. A hidroxilação de permanaganato ou tetróxido de ósmio de cis-3-hexeno formaria o meso isômero desejado. Do trans-3-hexeno seria necessário primeiro epoxidar o alceno com um perácido, seguido pela abertura do anel com íon hidróxido. Este exemplo ilustra uma característica comum na síntese: freqüentemente há mais de um procedimento eficaz que leva ao produto desejado.
Sínteses mais longas em várias etapas requerem análise e reflexão cuidadosas, já que muitas opções precisam ser consideradas. Como um jogador de xadrez especialista avaliando os prós e contras de longo alcance de movimentos potenciais, o químico deve avaliar o sucesso potencial de vários caminhos de reação possíveis, focando no escopo e nas limitações que restringem cada uma das reações individuais sendo empregadas. Essa pode ser uma tarefa difícil, cuja habilidade é adquirida com a experiência e, muitas vezes, por tentativa e erro.
Os três exemplos mostrados a seguir são ilustrativos. O primeiro é um problema simples de conversão de grupo funcional, que pode inicialmente parecer difícil. Muitas vezes, é útil trabalhar esses problemas de trás para frente, começando pelo produto. Neste caso, deve ser evidente que o ciclohexanol pode ser substituído por ciclohexanona, uma vez que esta poderia ser feita por uma simples oxidação. Além disso, uma vez que o ciclohexano (e alcanos em geral) é relativamente não reativo, a bromação (ou cloração) parece ser um primeiro passo óbvio. Neste ponto, somos tentados a converter o bromociclohexano em ciclohexanol por uma reação SN2 com o íon hidróxido. Esta reação seria, sem dúvida, acompanhada pela eliminação de E2, então seria mais limpo, embora um passo a mais, primeiro fazer ciclohexeno e depois hidratá-lo por qualquer um dos vários métodos (por exemplo, oximercuração e hidroboração), incluindo aquele mostrado clicando no diagrama
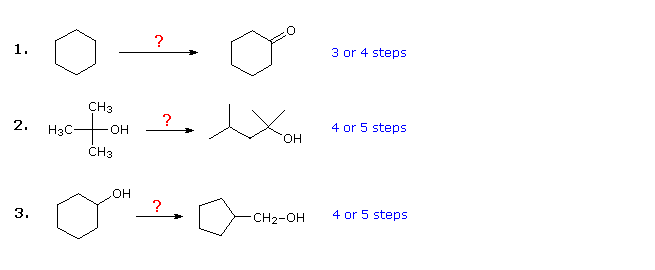 Resposta
Resposta
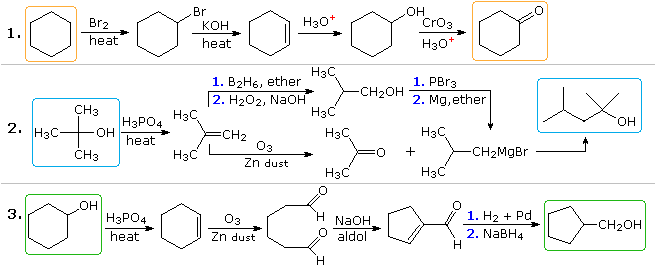
Soluções plausíveis para o segundo e terceiro problemas também aparecerão acima neste ponto. No problema 2, o produto desejado tem sete átomos de carbono e o material de partida tem quatro. Claramente, dois intermediários derivados do composto de partida devem ser unidos, e um carbono deve ser perdido, antes ou depois que essa ligação ocorrer. A função álcool 3º no produto sugere a formação por uma adição de Grignard a uma cetona, e o isobuteno parece ser um bom precursor para cada um desses reagentes, como mostrado. O reagente e os compostos do produto no terceiro problema são isômeros, mas algum tipo de quebra de ligação e seqüência de formação de ligação é claramente necessária para que essa mudança estrutural ocorra. Um procedimento possível é mostrado acima. O rearranjo catalisado por ácido do óxido de ciclohexeno, seguido por redução, também pode servir.
A abordagem útil de trabalhar sínteses começando da molécula alvo e retrocedendo para materiais de partida mais simples foi formalizada pelo Prof. E. J. Corey (Harvard) e denominada análise retrosintética. Neste procedimento, a molécula alvo é transformada progressivamente em estruturas mais simples, desconectando ligações carbono-carbono selecionadas. Essas desconexões repousam em transformações, que são o reverso de construções sintéticas plausíveis. Cada estrutura mais simples, assim gerada, torna-se o ponto de partida para outras desconexões, levando a um conjunto ramificado de intermediários inter-relacionados. Uma transformação retrosintética é representada pelo símbolo = >, conforme mostrado abaixo para os exemplos anteriores 2 & 3. Assim que uma análise completa for realizada , a síntese desejada pode ser realizada pela aplicação das reações subjacentes às transformações.
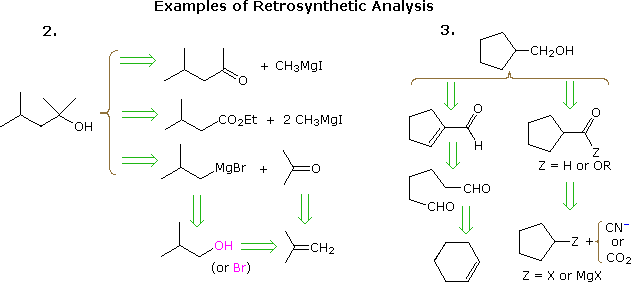
O diagrama acima não fornece um conjunto completo de transformações para esses alvos compostos. Quando um material de partida é especificado, como nos problemas acima, as vias propostas devem refletir essa restrição. Assim, as opções de éster de 4-metil-2-pentanona e 3-metilbutirato no exemplo 2, embora inteiramente razoáveis, não se encaixam bem com um início de terc-butanol. Da mesma forma, um intermediário de ciclopentil pode fornecer uma rota excelente para o produto no exemplo 3, mas não atende às condições especificadas do problema.
A análise retrossintética é especialmente útil quando se considera moléculas relativamente complexas sem restrições de material de partida. Se for conduzido sem preconceito, às vezes aparecem possibilidades incomuns e intrigantes. Infelizmente, a complexidade molecular (composta de tamanho, funcionalidade, incorporação de heteroátomo, conectividade cíclica e estereoisomeria) geralmente leva a árvores de transformação muito grandes e amplamente ramificadas. A análise assistida por computador tem se mostrado útil, mas no final os instintos e a experiência do químico desempenham um papel crítico para chegar a um plano sintético bem-sucedido. Alguns exemplos relativamente simples, a maioria com restrições de material inicial, são fornecidos abaixo.
Exercícios
Perguntas
Q9.9.1
Começando no 3-hexino, preveja rotas sintéticas para alcançar:
A – cis-3-hexeno
B – 3,4-dibromohexano
C – 3-hexanol
Q9.9.2
Começando com acetileno e quaisquer haletos de alquila, propomos uma síntese para fazer (a) pentanal e (b) hexano.
Soluções
S9.9.1

S9.9.2
.png?revision=1)
Colaboradores e atribuições
-
Dr. Dietmar Kennepohl FCIC (Professor de Química, Universidade Athabasca)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, Professor Emérito (Michigan State U.), Virtual Textbook of Organic Chemistry